小辉同学通过参考资料知道:Mg+CuO
MgO+Cu.为探究该反应并采用热还原法制取金属铜,他在老师的指导下进行如下实验:将镁粉和氧化铜按一定比例充分混合,隔绝空气加热一段时间后,得到固体M.请你与小辉同学一起对该固体M进行探究.(资料:常温下,镁不与水发生反应;) △ .
【对固体M的成分猜想】
猜想1:氧化镁和铜; 猜想2:氧化镁和铜,还可能含有氧化铜;
猜想3:氧化镁和铜,还可能含有镁粉;
猜想4:氧化镁和铜,还可能含有______;
【进行实验】实验流程见下图:
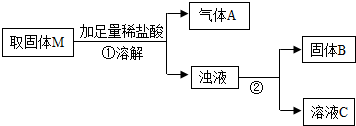
【问题讨论】
(1)根据步骤①中产生的现象,可以判断上述猜想______一定不成立.
(2)步骤②的操作名称是______,它与步骤①共同用到的玻璃仪器是烧杯、______.
(3)产生气体A的反应方程式为______,固体B的化学式______,步骤①中一定发生的反应有______个.
(4)加热一段时间后,固体M中除镁粉外,是否还有氧化铜剩余?即猜想4是否成立.
①小红认为可根据上述实验中溶液C显蓝色的现象来判断,则发生反应的方程式为______.
②小辉认为可根据固体M与稀硫酸在微热的条件下充分反应后所得固体B的质量是否增加来判断.若固体B增加,则发生反应的方程式为______.
【对固体M的成分猜想】将镁粉和氧化铜按一定比例充分混合,隔绝空气加热一段时间后,发生反应:Mg+CuO
MgO+Cu,得到固体M,若镁粉和氧化铜恰好完全反应,则固体M为氧化镁和铜;若氧化铜过量,则固体M为氧化镁、铜和氧化铜;若镁粉过量,则固体M为氧化镁、铜和镁粉;若反应没有进行完全,反应物镁粉和氧化铜有剩余,则固体M为氧化镁、铜、镁粉和氧化铜;故猜想4填氧化铜和镁; △ .
【问题讨论】(1)根据步骤①,固体M中加入足量稀硫酸有气体生成,说明固体M中一定有镁粉,猜想1、2一定不成立;
(2)把浊液中的固体和溶液分开采用过滤的方法,用到玻璃仪器为烧杯、漏斗、玻璃棒,与步骤①(溶解)共同用到的玻璃仪器是烧杯、玻璃棒;
(3)镁粉与稀硫酸反应生成硫酸镁和氢气,化学方程是Mg+H2SO4=MgSO4+H2↑;铜不与稀硫酸反应,故固体B的化学式为
Cu;步骤①发生的化学反应有2个,一是镁粉与稀硫酸反应,二是氧化镁与稀硫酸反应生成硫酸镁和水;
(4)判断固体M中是否有氧化铜剩余,
①氧化铜与稀硫酸反应生成硫酸铜和水,硫酸铜溶液为蓝色,可根据上述实验中溶液C显蓝色的现象来判断;化学方程式为
CuO+H2SO4=CuSO4+H2O;
②镁和硫酸铜反应,镁置换出硫酸铜中的铜,使固体质量增加,可根据固体M与稀硫酸在微热的条件下充分反应后所得固体B的质量是否增加来判断,若固体B增加,则发生反应的方程式为Mg+CuSO4=MgSO4+Cu.
故答案为:【对固体M的成分猜想】氧化铜和镁;
【问题讨论】(1)1、2;
(2)过滤,烧杯、玻璃棒;
(3)Mg+H2SO4=MgSO4+H2↑,Cu,2;
(4)①CuO+H2SO4=CuSO4+H2O,②Mg+CuSO4=MgSO4+Cu.
