孔雀石[碱式碳酸铜,主要成分是Cu2(OH)2CO3]具有色彩浓淡的条状花纹(如图),是矿物中最吸引人的装饰材料之一,也是人类最早冶炼铜的原料.
冶炼铜的反应原理为:Cu(OH)2CO3
2CuO+CO2↑+H2O △ .
2CuO+C
2Cu+CO2↑ 高温 .
某校课外小组同学在实验室验证上述反应.
(1)加热分解碱式碳酸铜,生成氧化铜.装置如下图所示.
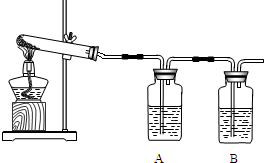
①瓶A中盛有的试剂是______,用来吸收水,证明碱式碳酸铜加热分解的产物中有水.
②瓶B中盛有的试剂是澄清石灰水,用来______,反应的化学方程式为______.
③反应结束,熄灭酒精灯前,应______.
(2)木炭和氧化铜反应,生成铜.
将木炭粉末和氧化铜粉末混合均匀,放进试管,加热充分反应.将试管中的粉末倒出,有铜生成,还有少量黑色粉末剩余.该小组同学设计方案验证黑色粉末的成分.
查阅资料:部分内容如下:木炭和氧化铜都是黑色粉末.氧化铜与稀硫酸反应生成硫酸铜,木炭与稀硫酸不反应.
| 操作和药品 | 现象 | 分析和结论 | |
| 方案Ⅰ | 取少量剩余黑色粉末,充分灼烧 | ①______________ ________________ | 原剩余黑色粉末是 氧化铜 |
| 方案Ⅱ | ②_______________ __________________ | ③_____________ _________________ | 原剩余黑色粉末是 氧化铜 |
(3)某同学探究在实际反应中,木炭和氧化铜反应生成铜时反应物的最佳质量比.设计方案如下:
| 配方1 | 配方2 | 配方3 | 配方4 | |
| 木炭质量(g) | 0.4 | 0.5 | 0.6 | 0.7 |
| 氧化铜质量(g) | 8 | 8 | 8 | 8 |
(1)A装置是吸收水分的装置因其为液体,故是浓硫酸;而检验二氧化碳的存在一般用到的是澄清石灰水.
故应填:①浓硫酸②碱式碳酸铜加热分解的产物中有二氧化碳,Ca(OH)2+CO2=CaCO3↓+H2O
(2)此实验分别是从两方面入手的①是给固体加热固体无变化说明没有碳,因为碳在加热时会生成二氧化碳;而加入稀硫酸全部反应,说明无碳,因为碳不与硫酸反应,氧化铜与硫酸反应生成硫酸铜的溶液.
故应填①黑色粉末没有变化(黑色粉末灼烧前后质量没有变化等) ②取少量剩余黑色粉末,加入足量稀硫酸,充分反应
③黑色粉末消失,生成蓝色溶液
(3)找到最佳质量比可通过一种物质的量不变,而改变另一种物质进行探究.故可填:具有控制变量的意识(使用控制变量法等)
