工业上常用大理石等原料制取安全无毒的杀菌剂过氧化钙(CaO2)。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
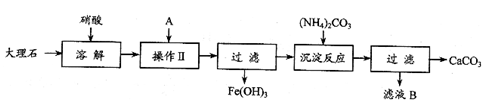

 (1)溶解大理石时,用硝酸而不用硫酸的原因是
(1)溶解大理石时,用硝酸而不用硫酸的原因是
。
 (2)操作Ⅱ中加入的A是少量的氨水,其目的是 。
(2)操作Ⅱ中加入的A是少量的氨水,其目的是 。
 (3)写出滤液B的一种用途: 。
(3)写出滤液B的一种用途: 。
 (4)写出检验滤液B中是否含Fe3+的方法是
(4)写出检验滤液B中是否含Fe3+的方法是
 。
。

 (5)写出加入碳酸铵所发生反应的离子方程式: 。
(5)写出加入碳酸铵所发生反应的离子方程式: 。
(6)CaO2与水反应会放出氧气,化学方程式为 。
(1)生成的硫酸钙微溶于水,阻止反应继续进行
(2)除去溶液中Fe3+
(3)作化肥(合理即给分)
(4)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+( 或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+)
或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+)
(5)Ca2++CO32-=CaCO3↓
(6)2CaO2+2H2O==2Ca(OH)2+O2
(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生
(2)大理石溶于硝酸后生成Ca(NO3)2、Fe(NO3)3,可通过向溶液中加CaCO3或氨水的方法调节pH,使Fe3+以Fe(OH)3的形式除去
(3)滤液B的溶质是NH4NO3,可以用作化肥
(4)Fe3+的检验一般用KSCN溶液:取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+
(5)过滤后的溶液中含有大量的Ca2+,加入碳酸铵发生复分解反应生成碳酸钙沉淀,反应离子方程式为Ca2++CO32-=CaCO3↓
(6)CaO2与水反应会放出氧气的同时生成相应的碱:2CaO2+2H2O==2Ca(OH)2+O2
