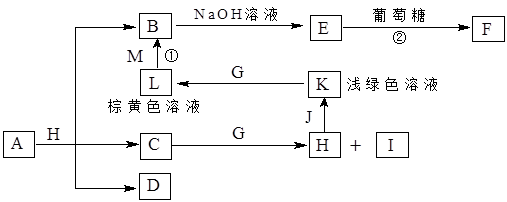
A~K为中学化学常见的物质,它们之间的转化关系如下图,部分生成物和反应条件等省略。已知C、D是由元素X、Y、Z中的两种组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色气体且不能燃烧,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。请回答下列问题:
1)写出A的化学式______________。
(2)比较Y与Z的原子半径大小:_________>_______(填写元素符号)。
(3)检验L溶液中金属阳离子的方法是__________________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,放出无色气体。请写出该反应的化学方程式
________________________________________________________
(1)CuCO3或Cu2(OH)2CO3或Cu(OH)2·CuCO3;
(2)C>O
(3)取少量L溶液于试管,滴加KSCN溶液,如溶液呈血红色,证明溶液含Fe3+
(或其他合理答案)
(4)3Cu2O+14HNO3 6Cu(NO3)2+2NO↑+7H2O(方程式3分,其他每空2分)
6Cu(NO3)2+2NO↑+7H2O(方程式3分,其他每空2分)
本题的关键是综合题目所给信息,判定各物质的化学式
依据G为氯气、I有漂白作用可初步判定C+G→H+I的反应可能是:Cl2+H2O=HCl+HClO;
盐酸与金属J生成的浅绿色溶液只能是FeCl2溶液:Fe+2HCl=FeCl2+H2↑;FeCl2被氯气氧化为棕黄色溶液L:FeCl3;而反应①是常用于制作印刷电路板,则知道M为铜,即:Cu+2FeCl3=2FeCl2+CuCl2;生成的B溶液CuCl2与NaOH生成Cu(OH)2与葡萄糖生成砖红色的F :Cu2O
A与盐酸生成CuCl2、水及D物质:X元素为H,与氧元素组成了C,也就是水;由Y、Z原子最外层电子数之和为10,可判定另一元素的最外层电子数为4,且可与氢元素形成无色且不可燃烧的气体D,也只能是CO2气体,所以Y、Z元素分别为C、O;
所以A为碳酸盐、铜盐,与盐酸生成了CuCl2、H2O及CO2,故A可能是CuCO3或Cu2(OH)2CO3
(2)同周期自左向右,原子半径逐渐减小
(3)考查铁离子的检验
(4)考查Cu2O与硝酸反应的方程式的书写及配平
