已知X是一种盐,H是一种古代劳动人民就已掌握冶炼技术的金属单质,F、P、J是常见的非金属单质,I、E、G都是工业上重要的碱性物质,P和J在一定条件下反应生成I。它们有右图所示的关系,试回答下列问题:
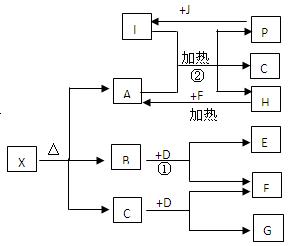
(1)G的化学式为 ;
(2)写出下列反应的化学方程式:
① ;
② ;
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,进一步探究X中各元素的质量关系。
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是
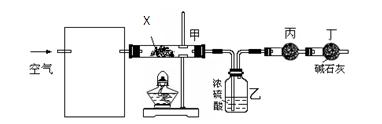
____________________________________________;
丙装置中药品的名称为________________,实验时,该药品未见明显变化,证明____________________________________________;
③ 如何判断X已完全分解?
__________________________________________________
___________________________________________________________________________________________________。
④ 更精确的测定得出如下数据:X受热后完全分解,固体由16.52 g变为12.00 g,装置乙增重1.44 g。写出X的化学式________________________。
请写出X与盐酸反应的化学方程式为:
(4)L是由3种元素构成的分子,能与I以1∶2的物质的量之比反应生成尿素
CO(NH2)2 和物质M,其中M能使硝酸酸化的硝酸银溶液产生白色沉淀,写出L的电子式 。
(1)NaOH(1分)
(2)①2Na2O2+2CO2=2Na2CO3+O2(1分) ②2NH3+3CuO N2+3Cu +3H2O (1分)
N2+3Cu +3H2O (1分)
(3)①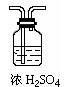 或
或
(多加NaOH溶液洗气瓶扣1分,共2分)
② 将X分解产生的水蒸气送入盛有浓硫酸的洗气瓶中(1分);无水硫酸铜(1分);
X分解产生的水蒸气全部被浓硫酸吸收(1分)
③ 连续两次加热、鼓气、冷却、称量甲装置的质量,质量差不超过0.1 g(2分)
④7CuCO3·8Cu (OH)2或Cu15(OH)16(CO3)7或15CuO·7CO2 ·8H2O (2分)
方程式:7CuCO3·8Cu (OH)2+30HCl=15CuCl2+7CO2+23H2O (2分)
(4)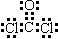 (2分)
(2分)
