水和溶液在生命活动和生产、生活中起着十分重要的作用。
(1)净水器中经常使用活性炭,主要利用活性炭的 性。
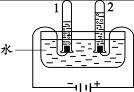
(2)下图实验中,当试管1中气体的体积为6mL时,试管2中气 体体积约为 mL;反应的化学方程式是 。
(3)农业生产常用溶质的质量分数为10% ~ 20%的NaCl溶液来选种。现将300g 25%的NaCl溶液稀释为10%的NaCl溶液,需要加水的质量为 g。
(4)甲、乙两物质的溶解度曲线如右图所示。20℃时,将等质量的甲、乙两种固体,分别加入盛有10 g水的A、B试管中,充分溶解后,可观察到如图所示的现象。则20℃ t℃(填“>”、“<”或“=”)。
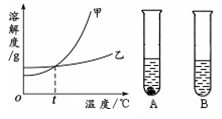
20℃时,对A试管进行如下操作,最终A试管中溶液
溶质的质量分数一定发生变化的是 (填字母序号)。
A.加少量水 b.加入少量甲物质
c.升温到40℃ d.蒸发部分溶剂,恢复到20℃
e.加入少量40℃甲的饱和溶液,恢复到20℃
(1)吸附 (2) 3 2H2O 2H2↑+O2↑
(3)450 (4) < c
题目分析:(1)净化水的方法有沉淀、过滤、吸附、蒸馏。沉淀包括静止沉淀和吸附沉淀,吸附沉淀时水中要加明矾,作用是明矾溶于水形成胶状物吸附杂质,使杂质沉降,达到净水的目的;过滤可将固体和液体分离;过滤只除去了难溶性物质,要用活性炭吸附水的颜色和异味;
(2)电解水实验中与正极产生的是氧气,用带火星的小木条检验,负极产生的是氢气,可用燃烧法检验,正负两极气体的体积比为1:2 ,质量比为4:32="1:8" ;
(3)溶液稀释过程中溶质的质量不变,设稀释后溶液的质量为X,那么300g×25%=10%X,X=750g,加水的质量=750g-300g=450g;
(4)根据试管中固体的溶解情况可知,A中有固体剩余,B中固体完全溶解,即甲的溶解度小于乙的溶解度。而t℃时甲乙的溶解度相等,那么20℃< t℃;要使A中的溶质质量分数变化,那么降温或升温或加大量的水使它变成不饱和溶液。
