(10分)有一包白色粉末可能由K2SO4、NaHCO3、BaCl2、FeCl3、KCl五种物质中的某几种组成,现进行如下实验:
① 将白色粉末加水溶解,得无色溶液。
② 向①中所得的无色溶液中加入NaOH溶液,观察到有白色沉淀A生成,过滤后,向
滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B。
根据上述现象判断:
A的化学式是 B的化学式是
(2)原白色粉末中一定含有 ,可能含有 ,
对可能含有的物质,可通过 (填实验名称)进一步检验。
((1)BaCO3 AgCl (2)NaHCO3、BaCl2 KCl 焰色
白色粉末加水后,溶解且得无色溶液,则其中必不含 ,即不含
,即不含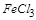 ;
;
溶液中加入NaOH溶液,观察到有白色沉淀A生成,表明其中含有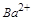 ,即含有
,即含有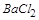 ;因为
;因为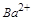 与
与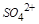 不能共存,所以其中不含
不能共存,所以其中不含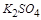 ,故白色沉淀
,故白色沉淀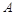 为
为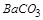 ;
;
滤后,向滤液中滴加硝酸酸化的AgNO3溶液,又得到白色沉淀B,表明其中含有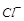 ,白色深沉
,白色深沉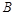 为
为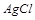 .
.
上述的实验无法证实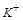 的存在与否,因而
的存在与否,因而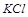 是否存在无法确定.要想确定其是否存在,通过焰色反应来完成,
是否存在无法确定.要想确定其是否存在,通过焰色反应来完成,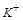 的在焰色反应中显示紫色。
的在焰色反应中显示紫色。
综上有白色沉淀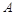 为
为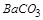 ,
,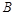 为
为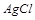 ,
,
原白色粉末中一定含有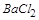 ,可能含有的物质为
,可能含有的物质为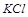 ;鉴定的存在用焰色反应.
;鉴定的存在用焰色反应.
