(12分)已知B是常见的金属单质,E为常见的气态非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
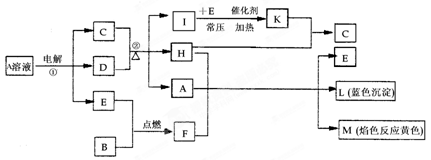
(1)F的电子式为 ,所含化学键为 ;
(2)反应①的离子方程式为 ;
(3)每生成1 mol K,反应放出98.3 kJ的热量,该反应的热化学方程式为 ;
(4)反应②的化学方程式为 ;
(5)化合物F与Na2S溶液反应,生成NaOH和S单质,试写出该反应的离子方程式为 。
(1)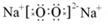 ;离子键,非极性共价键
;离子键,非极性共价键
(2)2Cu2++2H2O 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
(3)SO2(g)+ O2(g)=SO3(g) △H=-98.3kJ/mol
O2(g)=SO3(g) △H=-98.3kJ/mol
(4)Cu+2H2SO4(浓)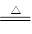 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(5)Na2O2+S2-+2H2O=2Na++S↓+4OH-
由所给信息可知,金属B的焰色反应为黄色,即钠,它在非金属单质中可以燃烧,说明E为氧气态,F为Na2O2;
I与氧气反的条件“常压、加热、催化剂”,可知I为SO2,氧化为SO3;H常温下为无色液体,即水,可与SO3化合为C:硫酸;
A溶液电解可得到硫酸、氧气及D,且D可与浓硫酸加热生成SO2、水及A,可知D为铜;
(1)Na2O2的电子式为: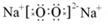 ,它为含有非极性共价键的离子化合物
,它为含有非极性共价键的离子化合物
(2)电解硫酸铜溶液:2Cu2++2H2O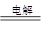 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
(3)SO2(g)+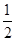 O2(g)=SO3(g) △H=-98.3kJ/mol
O2(g)=SO3(g) △H=-98.3kJ/mol
(4)Cu+2H2SO4(浓)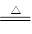 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(5)Na2O2与Na2S溶液生成了硫单质,发生了氧化还原反应:Na2O2+S2-+2H2O=2Na++S↓+4OH-
