.(15分)下图中,化合物A, B,G,M, L, J 均由两种元素组成,其中A是一种无色液体, G是极易溶于水的常见气体,L分子中的电子数为18(L的相对分子量不超过34)。反应⑤是工业上制X的主要反应之一,化合物H具有强的氧化性,可由常见卤素气体与苛性钾溶液在常温下反应而制得。N的溶液呈浅绿色。(注;有些反应的水也略去)

请按要求填空:
(1)写出下列物质的化学式:
L: ,X: 。
(2)反应④的离子方程式为: 。
(3)反应⑥的离子方程式为: 。
(4)略过量的H溶液与N溶液混合有大量的沉淀产生,其离子方程式为:
。
(5)B中F的质量分数为30.77%,则B的化学式为: 。
(1)N2H4 HNO3
(2)Fe+4H++2NO3-=Fe2++2NO2↑+2H2O
(3) Cl-+2NH3=N2H4+Cl-+H2O
(4)5ClO-+2Fe2++5H2O=2Fe(OH)3↓+4HClO+Cl-
(5) FeN9
A是一种无色液体,即为水,水电解生成氢气和氧气N的溶液呈浅绿色说明含有亚铁离子。化合物H具有强的氧化性,可由常见卤素气体与苛性钾溶液在常温下反应而制得,因此H是KClO。G是极易溶于水的常见气体,因此G是氨气或HCl。若G是HCl,则L是次氯酸或氯化钾,都不符合18电子,故G是氨气,氨被H氧化生成18电子的微粒是N2H4,即L是N2H4,方程式为Cl-+2NH3=N2H4+Cl-+H2O。D和E生成氨气,则D是氢气,E是氮气,C是氧气,氨气发生催化氧化生成水和NO,J是NO。通过反应⑦可得出M是二氧化氮,溶于水生成硝酸和NO,即X为硝酸,在加热时被铁还原生成二氧化氮。因此F是铁。B中F的质量分数为30.77%,所以B中N和Fe的个数比是
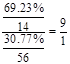 ,所以化学式为FeN9
,所以化学式为FeN9
