(12分)化合物A是一种重要的光化学试剂。A~H之间相互转化关系如下图所示:(部分反应物、生成物没有列出)
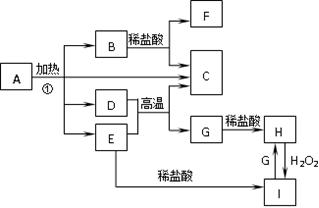
已知:化合物A中含二种阳离子和一种带二个单位负电荷的阴离子,三种离子的个数比为3∶1∶3。阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍。C、D都为气体且含有元素种类相同,C能使澄清石灰水变浑浊,E是一种红棕色的颜料,F的焰色反应呈紫色,I能使KSCN溶液显红色。
回答下列问题:
(1)C的电子式为: ;A的化学式为: 。
(2)D+E→C+G的化学方程式: 。
(3)H+H2O2+HCl→I的离子方程式: 。
(4)在A的溶液中滴入酸性高锰酸钾溶液,高锰酸钾溶液紫色褪去,而在A的溶液中滴入硫氰化钾溶液,溶液呈红色。产生上述现象的主要原因是
_________________________________________________________________________。
(1) 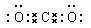 (2分) K3Fe(C2O4)3(2分)
(2分) K3Fe(C2O4)3(2分)
(2) 3CO + Fe2O3 2Fe + 3CO2(2分) (3) 2Fe2++ H2O2 + 2H+= 2Fe3++ 2H2O(2分)
2Fe + 3CO2(2分) (3) 2Fe2++ H2O2 + 2H+= 2Fe3++ 2H2O(2分)
(4) KMnO4被C2O42-还原(2分) Fe3+与SCN-生成了红色的Fe(SCN)3(2分)
本题属于无机框图题。E是一种红棕色的颜料,说明E是氧化铁。因此I是氯化铁,则H是氯化亚铁,所以G是单质铁。D能把氧化铁中的铁还原生成单质铁,且D的氧化产物能使澄清石灰水变浑浊,所以D是CO2,C是CO。F的焰色反应呈紫色,所以B应该是碳酸钾。又因为A的阴离子中各元素的质量分数与C相同且相对分子质量是C的2倍,说明阴离子是C2O42-。根据A中,三种离子的个数比为3∶1∶3,结合电荷数为0可知,A的化学式为K3Fe(C2O4)3。由于A中的阴离子具有还原性,能被酸性高锰酸钾溶液氧化,所以高锰酸钾溶液的紫色会褪去。A周期溶液中能电离出铁离子,Fe3+与SCN-生成了红色的Fe(SCN)3。
