(12分)下列物质A~F是我们熟悉的单质或化合物,其中A、B是常见的金属,E在常温下是黄绿色气体;在适当的条件下,他们之间可以发生如图所示的转化。
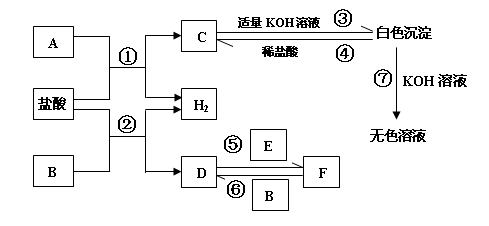
试回答下列问题:
(1)A的化学式是 ;
(2)在①—⑦反应中,属于氧化还原反应的有 ,其中属于置换反应的有 ;
(3)写出上图中白色沉淀与NaOH溶液反应的离子方程式:
;
(4)请写出在D的溶液中滴加NaOH溶液的过程中发生反应的化学方程式
、
。
(5)检验上图无色溶液中金属阳离子的方法是(填写实验名称): ,
现象是 。
(1)Al (1分)
(2)①②⑤⑥ ①②(每空1分,共2分,只要有错即为0分)
(3)Al(OH)3 + OH- = AlO2- + 2H2O (2分)
(3)FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl ; (2分)
4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3(2分)
(化学方程式没配平给1分,HCl+NaOH=NaCl+H2O不作要求)
(4)焰色反应(1分);透过蓝色钴玻璃观察火焰颜色为紫色(2分)
A、B两金属均可与盐酸生成氢气及氯化物C及D,则为较活泼金属;C与KOH生成的碱可溶于过量的KOH,则可知C为铝;
氯化物D可与氯气(E为黄绿色气体)生成氯化物F,F又可被金属B生成D,说明B为变价金属,在常见的金属中,可知为铁
(1)A为Al
(2)涉及反应为:①2Al+6HCl=2AlCl3+3H2↑ ②Fe+2HCl=FeCl2+H2↑
③AlCl3+3KOH=Al(OH)3↓+3KCl ④Al(OH)3+3HCl=AlCO3+3H2O
⑤2FeCl2+Cl2=2FeCl3 ⑥2FeCl3+Fe=3FeCl2 ⑦Al(OH)3+KOH=KAlO2+2H2O
其有化合价有改变的反应即属于氧化还原反应:①②⑤⑥
属于置换反应(单质与化合物生成单质与化合物)的有①②
(3)Al(OH)3+OH-=AlO2-+2H2O
(4)FeCl2与碱液生成的Fe(OH)2呈白色,但在空气中即被氧化,最终生成红褐色的Fe(OH)3:FeCl2 + 2NaOH = Fe(OH)2↓ + 2NaCl;4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3
(5)无色溶液的KAlO2,钾离子一般通过焰色反应来检验,一定要透过蓝色钴玻璃来观察火焰的颜色
