(9分)X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系:
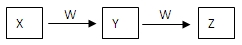
(1)若该反应是非氧化还原反应
①X为强碱溶液,W是形成酸雨的主要气体,则Y到Z的离子方程式为 。
②X是一种盐,逐滴加入W,溶液中开始无气泡,后产生无色无味气体Z,则Z的电子式为 。
(2)若该反应是氧化还原反应
①X常温下为黄绿色气体,W是生活中应用最广泛的金属之一,则Y的水溶液中加入W生成Z溶液的离子方程式为 。
②X常温下为气体化合物,Z是一种红棕色气体,X气体的检验方法 。X转化为Y的化学方程式为 。
(1)①SO32-+SO2+ H2O=HSO3-(2分) ②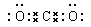 (2分)
(2分)
(2)①2Fe3+ + Fe = 3Fe2+(2分)
②湿润的红色石蕊试纸变蓝 (1分) 4NH3+5O2=4NO+6H2O(2分)
(1)形成酸雨的主要气体是SO2,所以Y是亚硫酸盐,亚硫酸盐继续吸收SO2,生成相应的酸式盐,所以离子方程式为SO32-+SO2+ H2O=HSO3-。碳酸盐和酸反应开始阶段不产生气体,当碳酸盐完全转化为碳酸氢盐后,再滴入酸才开始出现CO2气体。CO2是由极性键形成的共价化合物,其电子式为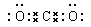 。
。
(2)黄绿色气体是氯气,应用最广泛的金属是铁,则Y是氯化铁,氯化铁氧化单质铁生成氯化亚铁,方程式为2Fe3+ + Fe = 3Fe2+。红棕色气体是NO2,则Y是NO,W是氧气,X是氨气。可以利用氨气是碱性气体进行检验,氨气发生催化氧化即生成NO,方程式为4NH3+5O2=4NO+6H2O。
