(14分)A、B、C、D、E、F六种的转化关系如右图,其中A为应用最广泛的金属,氧化物E既能与盐酸反应,又能与NaOH溶液反应。X、Y属于同一周期,且核电荷数相差4。
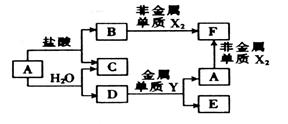
上述转化中某些反应条件未指出,请回答下列问题:
(1)指出C中的化学键类型: ;D的化学式为 ;元素X、Y的原子半径大小顺序是 (用元素符号表示)。
(2)E与NaOH溶液反应的离子方程式为 。
(3)反应A+H2O→C+D的化学方程式为 。
(4)F能促进H2O的电离,其原因是 (用离子方程式表示)。
(5)250C时,将pH=1的盐酸与pH=12的NaOH溶液按体积比1:9混合(混合时溶液体积变化忽略不计),混合均匀后所得溶液的pH= 。
每空2分,共14分
(1)共价键; Fe3O4; Al>Cl (各2分)
(2)Al2O3+2OH-=2AlO2-+H2O (2分)
(3)Fe + 4H2O(g) =高温=Fe3O4 + 4H2 (2分)
(4) 3Fe3+ + 3H2O 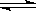 Fe(OH)3 + 3H+ (2分)
Fe(OH)3 + 3H+ (2分)
A为应用最广泛的金属则为铁,与盐酸反应,生成氯化亚铁和氢气,铁与水反应生成Fe3O4和H2,即 Fe + 4H2O(g) ==Fe3O4 + 4H2 ,那么C是氢气,存在的化学键是共价键,B为氯化亚铁,非金属单质X2为氯气,所以Y为Al ,F为氯化铁;氧化物E既能与盐酸反应,又能与NaOH溶液反应,E为Al2O3,Al2O3+2OH -=2AlO2-+H2O。
-=2AlO2-+H2O。
F能促进H2O的电离是因为Fe3+发生了水解,3Fe3+ + 3H2O 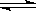 Fe(OH)3 + 3H+;(5)中pH=12的NaOH溶液中OH-浓度为0.01mol/l,混合时H+过量,混合后CH+=(0.1×1-0.01×9)/10=0.001 mol/l,PH=3
Fe(OH)3 + 3H+;(5)中pH=12的NaOH溶液中OH-浓度为0.01mol/l,混合时H+过量,混合后CH+=(0.1×1-0.01×9)/10=0.001 mol/l,PH=3
(5) 3 (2分)
