(17分)A、B、C、D、E五种元素原子序数依次增大,除E外均为短周期主族元素,B、C、D同周期,A、D同主族。A的最外层有三个未成对的电子,B是同周期第一电离能最小的元素,C的原子结构示意图为: ,E的价层电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A _______ B_______ C _______ D _______
(2)用元素符号表示A、C、D电负性由小到大的顺序____________。
(3)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是_____。
(4) D的氢化物比A的氢化物的沸点_____(填"高"或"低"),A的氢化物分子立体构型为________。
(5) E元素在周期表的位置是______________。
(6) B、C、D最高价氧化物的晶体类型是分别是______、________、______。
(1) N Na Si P (2) Si<P<N (3) HNO3 (4) 低,三角锥形
(5)第四周期VIII族 (6)离子晶体、原子晶体、分子晶体
考查元素原子的电子排布规律即元素周期表和元素周期律。
(1)C的原子结构示意图为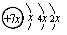 ,所以x=2,即C是硅元素。B、C、D同周期,A、D同主族,因此A是第二周期元素。A的最外层有三个未成对的电子,所以A是氮元素,则D是磷元素。金属性越强,电离能越小,所以B是第三周期的钠元素。根据E的价层电子排布式3d64s2并结合构造原理可得出E是铁元素。
,所以x=2,即C是硅元素。B、C、D同周期,A、D同主族,因此A是第二周期元素。A的最外层有三个未成对的电子,所以A是氮元素,则D是磷元素。金属性越强,电离能越小,所以B是第三周期的钠元素。根据E的价层电子排布式3d64s2并结合构造原理可得出E是铁元素。
(2)非金属性越强,电负性越大,非金属性是Si<P<N,则电负性也Si<P<N。
(3)非金属性越强,最高价氧化物对应水化物的酸性越强。
(4)氨气中存在氢键,所以其沸点高于PH3的。
(5)铁属于第四周期第VIII族。
(6)B、C、D最高价氧化物分别是Na2O、SiO2、P2O5,其晶体类型分别是离子晶体、原子晶体、分子晶体。
