(11分)由短周期元素组成的10种物质A~J间有下图所示的转化关系。已知A、B为同周期相邻元素的单质,其余均为化合物;通常状况下A为固体,B、D为气体,F为液体;A和G的浓溶液加热时反应生成D和F;J在光照时有I生成。试回答:
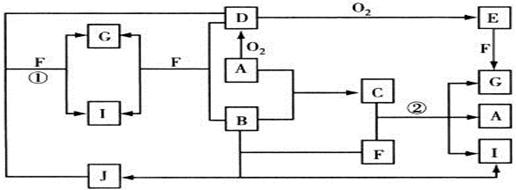
(1)写出下列物质的化学式:B_________,E__________,F的结构式__________。
(2)反应①的离子方程式为______________________________;
(3)足量铁与G的热的浓溶液反应所得气体是 ;
铁与B反应的化学方程式 。
(4)C是一种重要的化工产品,为易挥发的樱桃红色液体。若反应②中生成的G、A和I的物质的量之比1︰2︰6,则C的电子式为 ,反应②的化学方程式为__ 。
(1)Cl2;SO3;H—O—H(每空1分,共3分)
(2)HClO+SO2+H2O=3H++SO42-+Cl-(2分) (3)SO2、H2(2分)
 (1分) (4)
(1分) (4)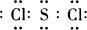 (2分)
(2分)
3SCl2+4H2O=H2SO4+2S↓+6HCl(2分)
常见的液体化合物是水,根据转化关系图可知A应该是固体非金属单质,A的最高价氧化物对应的水化物又可以和A反应生成水,所以A水S,D是SO2,E是SO3,G是H2SO4。A、B为同周期相邻元素的单质,且B是气体,所以B是氯气。氯气溶于水生成HCl和HClO,HClO光照分解即得到HCl,所以J是HClO,I是HCl。HClO和氯气均具有氧化性,可以氧化SO2生成硫酸,而自身被还原生成HCl。C是氯和硫构成的化合物,该化合物溶于水生成硫酸、单质硫和HCl。
(1)结构式是用一根短线表示一对孤电子对,所以H2O结构式为H—O—H。
(3)因为铁是过量的,而随着反应的进行,浓硫酸的浓度会降低,当达到一对浓度后,浓硫酸变为稀硫酸,因此会生成氢气。
(4)H2SO4、S、HCl的物质的量之比是1︰2︰6,所以根据原子守恒可知硫原子和氯原子的个数之比是1︰2,因此C的化学式为SCl2,组成元素均是非金属元素,所以是通过共价键形成的共价化合物,电子式为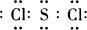 。
。
