(9分)有A、B、C、D、E、F、G、H、I等九种常见物质,它们的转化关系(反应条件未注明)如下图所示。已知:B、C、F为单质,常温常压下,B为固态,C、F为气态;化合物中仅A、E为气态;常温下,D为淡黄色粉末,H的焰色反应为黄色。G为无色液体。
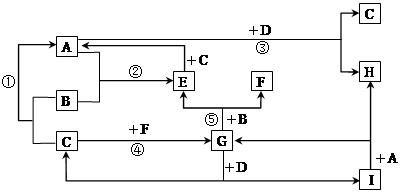
(1)写出G与D反应的离子方程式___________________________。
(2)写出B与G反应的化学方程式_____________________________。
(3)在①、②、③、④、⑤五个反应中,△H>0的反应是___(填代号)。
(4)E是一种可燃性气体,已知4.0gE在氧气中完全燃烧放出71kJ热量,写出该反应的燃烧热的热化学方程式: __________________________
(5)请写出化合物A的电子式____________________
(1) 2Na2O2+2H2O=4Na++4OH-+O2↑ (2分)
(2)C+H2O CO+H2 (2分)(3)②、⑤ (2分)
CO+H2 (2分)(3)②、⑤ (2分)
(4) CO(g)+1/2O2(g)=CO2(g) ;△H=-497kJ/mol (2分) (5)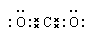
本题是无机框图题,关键是找准突破点。D为淡黄色粉末,H的焰色反应为黄色,G为无色液体,所以D是过氧化钠,G是水。F是气态氢氧化钠单质,E是气态化合物,所以B是碳,F是氢气,E是CO。则A是CO2,C是氧气,H是碳酸钡,I是氢氧化钠。
(3)考查常见的放热反应和吸热反应。一般金属和水或酸反应,酸碱中和反应,一切燃烧,大多数化合反应和置换反应,缓慢氧化反应如生锈等是放热反应。大多数分解反应,铵盐和碱反应,碳、氢气或CO作还原剂的反应等是吸热反应。所以②⑤是吸热反应。
(4)燃烧热是指在一定条件下,1mol可燃物尾气燃烧生成稳定的氧化物时发出的热量,所以CO的燃烧热的热化学方程式为CO(g)+1/2O2(g)=CO2(g) ;△H=-497kJ/mol。
(5)CO2是由极性键形成的共价化合物,电子式为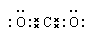 。
。
