(13分) A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题:
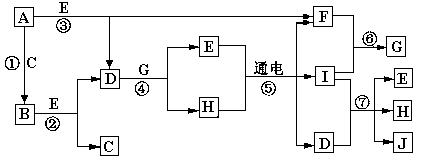
(1)B中的化学键有 , E的电子式 。
(2)写出反应⑦的离子方程式 __________________________。
(3)上述七个反应中属于氧化还原反应的是_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)极附近溶液由无色变为红色,其原因是 。
(1)离子键、非极性键 (2分)  (2分)
(2分)
(2)Cl2+2OH-=Cl-+ClO-+H2O(2分)
(3)①②③⑤⑥⑦(2分)
(4)阴极(2分),在阴极由于H+得到电子产生H2,破坏了水的电离平衡,促进水继续电离,导致溶液中c(OH-)>c(H+),溶液呈碱性,所以阴极附近溶液变为红色(3分)
本题是无机框图题,根据是找准突破点。B为淡黄色粉末,则B是过氧化钠,所以A是钠,C是氧气。E在常温下为液体,且E可由C、F合成,所以E是水,F水氢气,D是氢氧化钠。J可用作杀菌消毒剂,根据反应⑤的条件可判断,I应该是氯气,因此H是氯化钠,G是氯化氢,J是次氯酸钠。

 关系时,冠的
关系时,冠的