问题
问答题
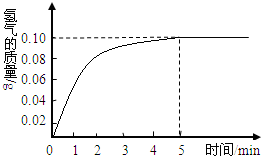
一块质量为8克的铜锌合金与96.85克的稀盐酸恰好完后反应,反应产生的氢气和反应时间关系如图所示.求:
(1)原合金中含铜多少克;
(2)反应后所得溶液溶质质量分数为多少.
答案
根据产生的氢气和反应时间关系图所示,恰好完全反应时放出氢气0.10g
设参加反应锌的质量为x,反应同时生成氯化锌的质量为y
Zn+2HCl=ZnCl2+H2↑
65 136 2
x y 0.10g
=65 x
x=3.25g2 0.10g
=136 y
y=6.8g2 0.10g
原合金中含铜的质量=8g-3.25g=4.75g
反应后所得溶液溶质质量分数=
×100%=6.8%6.8g 3.25g+96.85g-0.10g
答:(1)原合金中含铜4.75克;
(2)反应后所得溶液溶质质量分数为6.8%.

 缺失,进行可摘局部义齿修复,基牙为
缺失,进行可摘局部义齿修复,基牙为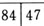 ,舌侧牙槽嵴为垂直型。采用大连接杆连接,其中
,舌侧牙槽嵴为垂直型。采用大连接杆连接,其中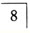 向中舌侧倾斜,其余基牙正常。
向中舌侧倾斜,其余基牙正常。