(每空2分,共16分)有X、Y、Z三种单质和甲、乙、丙三种常见的化合物,它们有如下图及叙述所示的关系:

(1).X、Y、Z都是短周期元素的单质,X元素原子的最外层电子数是其次外层电子数的2倍;Y元素有两种常见单质,二者质量相等时其物质的量之比为3 :2;Z元素原子的次外层电子数是其最外层电子数的4倍。则:
①写出化合物甲的电子式___________________;
②写出Z与甲反应的化学方程式__________________________________________________;
(2).X、Y、Z都是非金属单质,X是原子晶体,Y、Z都是分子晶体,X、Y都能与强碱溶液反应;乙的水溶液是工业三酸之一,也是实验室常用试剂。则:
①写出X与NaOH溶液反应的离子方程式________________________________________;
②Z与甲的反应的一种重要工业用途是___________________________________________;
③在①所得溶液中加入乙的溶液,观察到的现象______________________________________________________________________ ;
(3).X、Z是常见金属,Z与甲的反应只有在高温下才能进行,甲是一种具有磁性的化合物,乙在工业上常用于制取Z单质。则:
①写出乙与NaOH溶液反应的化学方程式_________________________________________________ ;
②将①所得溶液与小苏打溶液的混合观察到的现象是___________________________________ ;
③将等物质的量的X和Z分别与足量的稀硫酸反应,当两种金属完全溶解后,得到气体的质量之比是____________________________。
(每空2分,共16分)(1)①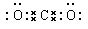 ; ②2Mg+CO2
; ②2Mg+CO2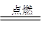
(2)①Si+2OH-+H2O= SiO32-+2H2↑ ; ②制取高纯硅; ③产生白色胶状沉淀;
(3)①Al2O3+2NaOH=2NaAlO2+H2O ; ②产生白色胶状沉淀; ③ 2 : 3
(1)根据元素的性质及结构可知,.X、Y、Z分别是C、O、Mg。
①甲是CO2,含有极性键的共价化合物,电子式为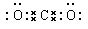 。
。
②镁能在CO2中燃烧,生成氧化镁和碳,方程式为2Mg+CO2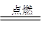
(2)能和强碱反应的非金属单质且是原子晶体的应该是硅,即X是Si。乙的水溶液是工业三酸之一,也是实验室常用试剂,所以乙是氯化氢,则Y是氯原子,Z是氢元素。
①硅和氢氧化钠反应生成硅酸钠和氢气,方程式为Si+2OH-+H2O= SiO32-+2H2↑。
②氢气在高温下含有四氯化硅可以制取高纯硅,
③盐酸是强酸,能制取硅酸,硅酸不溶于水,因此现象是产生白色胶状沉淀。
(3)甲是一种具有磁性的化合物,则甲是四氧化三铁,所以Z是铝,X是铁,乙是氧化铝,Y是氧气。
①氧化铝是两性氧化物,能和氢氧化钠溶液反应生成偏铝酸钠和水,方程式为Al2O3+2NaOH=2NaAlO2+H2O。
②偏铝酸钠能和碳酸氢钠反应生成氢氧化铝沉淀和碳酸钠,所以现象是产生白色胶状沉淀。
