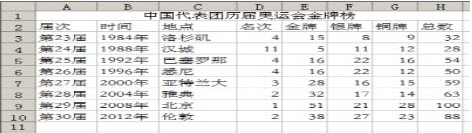
(11分)如下图所示:已知A、D、E、F是中学化学中常见单质,B、C是氧化物,且B的相对分子质量是232。
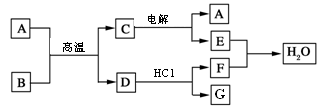
请填空:
(1) A是________,E是________(填化学式)
(2) C电解的化学方程式为________________________。
(3) 写出工业以B为原料冶炼D的化学方程式___________________、_________________。
(4) 熔融状态下,金属钠和G能组成可充电电池(装置示意图如下),反应原理为:Na + G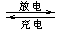 NaCl +D
NaCl +D
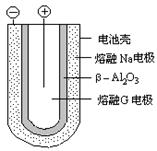
放电时,正极反应为___________________,阳离子迁移途径为________________________。
(1)Al O2 (2)2Al2O3(熔融)  4Al+3O2↑
4Al+3O2↑
(3)Fe3O4+ 4CO  3Fe+4CO2(1分) 3 Fe3O4+8Al
3Fe+4CO2(1分) 3 Fe3O4+8Al  9Fe+ 4Al2O3
9Fe+ 4Al2O3
(4)Fe 2++ 2e -= Fe Na+从负极经β─Al2O3移向正极
根据框图转化可知,A→D是置换反应,且B的相对分子质量是232,单质A需要通过电解生成,所以A是铝,B是四氧化三铁,C是氧化铝,D是铁,E是氧气,F是氢气,G是氯化亚铁。
(2)电解氧化铝生成铝和氧气,方程式为2Al2O3(熔融)  4Al+3O2↑ 。
4Al+3O2↑ 。
(3)铁的冶炼需要通过还原剂还原,所以方程式为Fe3O4+ 4CO  3Fe+4CO2或3 Fe3O4+8Al
3Fe+4CO2或3 Fe3O4+8Al  9Fe+ 4Al2O3。
9Fe+ 4Al2O3。
(4)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。所以钠是负极,正极是亚铁离子得到电子,方程式为Fe 2++ 2e -= Fe。原电池中阳离子从负极流向正极,即Na+从负极经β─Al2O3移向正极。