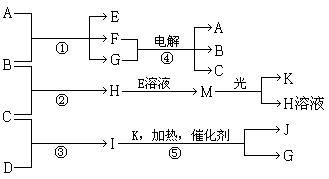
(15分)物质A、E、F的焰色反应呈黄色,物质I的1个分子由4个原子组成并共含有10个电子,B、C、D、K在常温下都是气体单质,G在常温下是无色液体,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应转化关系如下图所示(部分反应条件已略去):
(1)写出物质的化学式:B M
(2)写出A物质的电子式 物质I是 分子(填极性或非极性)
(3)0.1mol/LE水溶液中各离子浓度由大到小的顺序为
(4)反应①的离子方程式
反应⑤的化学方程式
(5)反应④中,若转移0.02mol电子后停止反应,溶液的体积是200mL,则此时溶液(不考虑电解产物的相互反应)的PH=_________。
(1)B:Cl2 M:HClO
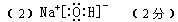 极性 (注意:此空1分,其余每空2分)
极性 (注意:此空1分,其余每空2分)
(3)c(Na+)>c(ClO-)>c(OH-)>c(H+)
(4)Cl2+2OH-=Cl-+ClO-+H2O
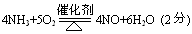
(5)13
物质I的1个分子由4个原子组成并共含有10个电子,所以I是氨气,则C是氢气,D是氮气。G在常温下是无色液体,因此G是水,则K是氧气,J是NO。A、E、F的焰色反应呈黄色,所以A是氢氧化钠,B是氯气,E是次氯酸钠,F是氯化钠,H是氯化氢,M是次氯酸。
(1)略
(2)氢氧化钠是含有离子键和极性键的离子化合物,电子式为 。氨气是三角锥形,所以是极性分子。
。氨气是三角锥形,所以是极性分子。
(3)次氯酸钠是强碱弱酸盐,水解显碱性,所以离子浓度大小顺序是c(Na+)>c(ClO-)>c(OH-)>c(H+)。
(4)见答案
(5)惰性电极电解食盐水的方程式为2NaCl+2H2O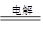 2NaOH+Cl2↑+H2↑,转移0.02mol电子时生成氢氧化钠是0.02mol,其浓度是0.1mol/L,所以pH=13。
2NaOH+Cl2↑+H2↑,转移0.02mol电子时生成氢氧化钠是0.02mol,其浓度是0.1mol/L,所以pH=13。
