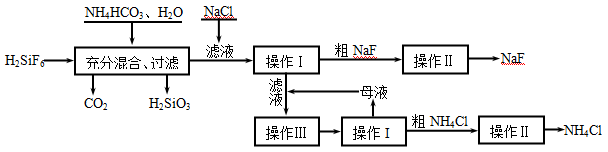
氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂。实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度分别为:
NH4Cl:10℃时33.3g、20℃时37.2g、30℃时41.4g;
NaF:20℃时4g;Na2SiF6:微溶。
请回答下列问题:
(1)指出副产品的用途: ;(任填一种即可)
(2)操作Ⅰ需要用到的玻璃仪器除玻璃棒、漏斗外,还有 ___ ;
(3)操作II的名称是 ;
(4)操作Ⅲ的具体过程是 、 ;
(5)上述流程中发生两步化学反应,请分别写出其化学方程式:
第一步: ;
第二步: ;
(6)流程中NH4HCO3必须过量,其原因是 ;
(11分)
(1)作肥料 (1分)
(2)烧杯 (1分)
(3)重结晶 (1分)
(4)蒸发浓缩、降温结晶 (各1分)
(5)6NH4HCO3 + H2SiF6 ="=" 6NH4F + H2SiO3↓ + 6CO2↑+ 3H2O
NH4F + NaCl ="=" NaF↓ + NH4Cl (各2分)
(6)保证H2SiF6反应彻底,否则在析出NaF时,会混入较多Na2SiF6杂质(2分)
题目分析:(2)操作Ⅰ是过滤操作,用到的玻璃仪器包括烧杯、玻璃棒、漏斗,故答案为:烧杯;(3)操作Ⅱ是将粗NaF洗涤除去其表面的杂质,以得到纯净的NaF,其过程为重结晶。(4)操作Ⅲ是将滤液中的溶质进一步提取,故操作是加热蒸发溶剂,析出大量固体后冷却,故答案为:除去NaF、NH4Cl 表面的杂质;蒸发浓缩溶液,析出多量固体后冷却;
(5)第一步反应的方程式,反应物有H2SiF6、和NH4HCO3,生成物有H2SiO3、CO2,根据质量守恒还应有NH4F,则反应的化学方程式为H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O,第二步反应是将第一步生成的NH4F转化为NaF,加入的反应物为NaCl,利用了物质在溶液中溶解度越小则优先析出的特性,所以NaF比NaCl的溶解性小,反应的化学方程式为
NH4F+NaCl=NH4Cl+NaF↓,
故答案为:H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O;NH4F+NaCl=NH4Cl+NaF↓;(6)流程中NH4HCO3必须过量,是指第一步操作中必须保证H2SiF6能全部反应,以防止生成Na2SiF6沉淀,影响制取物质的纯度,
故答案为:保证H2SiF6能全部反应;防止在加入NaCl后H2SiF6与NaCl反应生成Na2SiF6沉淀混入NaF中影响NaF纯度。
点评:本题考查较为综合,题目难度角度,注意把握制备流程的反应原理,根据题中信息解答,本题易错点为相关化学方程式的书写,注意从质量守恒的角度思考。
