(16分)A、B、C、D、E为中学化学常见的单质或化合物,相互转化关系如图所示(部分产物略去):
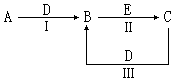
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,C、D均为空气的主要成分,E是一种有毒气体.
①C的电子式为_______________.
②写出反应Ⅱ的化学方程式______________________.
(2)若A是淡黄色化合物,常温下D是无色气体,C中含有的阴、阳离子均为10电子粒子.
①C中所含化学键的类型是____________.
②写出反应Ⅲ的离子方程式______________________.
(3)将(2)中一定量的气体D通入2 L C的溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl物质的量关系如图所示(忽略气体的溶解和HCl的挥发).
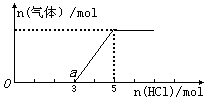
①O点溶液中所含溶质的化学式为_____________,a点溶液中各离子浓度由大到小的关系是_______________.
②标准状况下,通入气体D的体积为_____L,C溶液的物质的量浓度为_____mol·L-1.
(1)①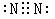 (2分) ② 2NO + 2CO
(2分) ② 2NO + 2CO 2CO2 + N2(2分)
2CO2 + N2(2分)
(2)①离子键、共价键(2分) ② 2OH- + CO2 = CO32- + H2O (2分)
(3)① Na2CO3、NaOH (2分) c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-) (2分)
② 44.8 (2分) 2.5 (2分)
(1)若A是能使湿润的红色石蕊试纸变蓝的气体,则A是氨气,所以D是氧气,B是NO,则C是氮气,电子式为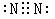 。由于E有毒,所以E是CO。NO具有氧化性,能氧化CO,生成CO2和氮气,方程式为2NO + 2CO
。由于E有毒,所以E是CO。NO具有氧化性,能氧化CO,生成CO2和氮气,方程式为2NO + 2CO 2CO2 + N2。
2CO2 + N2。
(2)若A是淡黄色化合物,则A是过氧化钠;常温下D是无色气体,所以D是CO2,则B是碳酸钠;C中含有的阴、阳离子均为10电子粒子,则C是氢氧化钠,含有离子键、共价键。E是氢氧化钙或氢氧化钡等。CO2和氢氧化钠反应的方程式为2OH- + CO2 = CO32- + H2O。
(3)(3)①由于碳酸钠和盐酸反应是分步进行的,方程式为Na2CO3+HCl=NaHCO3+NaCl、NaHCO3+HCl=NaCl+H2O=CO2↑。所以根据图像可知所得溶液中含有氢氧化钠,即O点溶液中所含溶质的化学式为Na2CO3、NaOH;a点溶液恰好是碳酸氢钠,由于水解程度大于电离程度,溶液显碱性,所以离子浓度大小关系是c(Na+)>c(Cl-)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-)。
②根据图像可知,生成CO2是2mol,则所得溶液中含有碳酸钠是2mol,所以消耗CO2是2mol,标准状况下的体积是44.8L;最终生成氯化钠是5mol,所以根据原子守恒可知,氢氧化钠是5mol,浓度是2.5mol/L。
