问题
填空题
(15分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体。
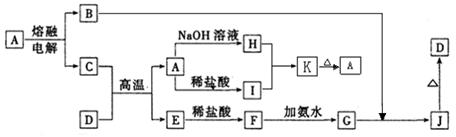
请回答下列问题:
(1)固体A的晶体类型为___________,K的化学式为 。
(2)C与D在高温下的反应在冶金工业上称为 反应,引发该反应的实验操作是_____ ______。
(3)G→J的化学方程式为____________。
(4)A→H的离子方程式为 。
(5)I的水溶液pH_____7(填“>”、“<”或“=”),原因是____(用离子方程式表示)。
答案
(1)离子晶体 …… (2分) Al(OH)3 ………………(2分)
(2)铝热反应………………(2分),在混合粉末上插上镁条,周围撒上少量KClO3,然后点燃镁条………………(1分)
(3)4Fe(OH)2+O2+2H2O=4Fe(OH)3………………(2分)
(4)Al2O3+2OH—=2AlO2—+H2O………………(2分)
(5)<(1分) Al3++3H2O Al(OH)3+3H+………………(2分)
Al(OH)3+3H+………………(2分)
本题属于无机框图题,关键是找准突破点。D是一种红棕色固体,所以D是氧化铁,则J是氢氧化铁。又因为A是一种高熔点物质,所以A是氧化铝,B是氧气,C是Al,E是铁,F是氯化亚铁,G是氢氧化亚铁,H是偏铝酸钠,I是氯化铝,K是氢氧化铝。氯化铝由于是强酸弱碱盐,水解显酸性,方程式为Al3++3H2O Al(OH)3+3H+。
Al(OH)3+3H+。
