(14分)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: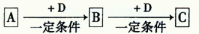
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为——————————————。
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则C中阴阳离子个数比为 ------ 。
(3)若D是常见过渡金属,欲将反应B+D→C设计成原电池,正极材料可以采用------ ,
正极的电极反应式为 —————— 。
(4)若D是一种常见的温室气体:A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为——— 。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 ———— 。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为——— 。
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,任写一个工业上采用氨水吸收B时,水溶液中发生的氧化还原反应的方程式 —-。
(1) 4NH3+5O2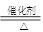 4NO+6H2O (2)1:2 (3) 石墨等 Fe3++e-=Fe2+
4NO+6H2O (2)1:2 (3) 石墨等 Fe3++e-=Fe2+
(4)CO32-+CO2+H2O=2HCO3- (5)AlO2- (6)O=C=O (7)2NH4HSO3+O2=2NH4HSO4等(1)若A能使湿润的红色石蕊试纸变蓝,则A是氨气;C为红棕色气体,则C是NO2。所以D是氧气,B是NO,因此A转化为B反应的化学方程式为4NH3+5O2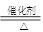 4NO+6H2O。
4NO+6H2O。
(2)若D是具有氧化性的单质,A属于短周期主族金属单质,则A是钠,D是氧气,B是氧化钠,C是过氧化钠,所以C中阴阳离子个数比为1︰2。
(3)若D是常见过渡金属,则D是铁,B中含有铁离子,C中含有亚铁离子。所以反应B+D→C设计成原电池,正极材料可以采用石墨等。原电池中正极得到电子,因此电极反应式是Fe3++e-=Fe2+。
(4)若D是一种常见的温室气体,则D是CO2。A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,所以A是氢氧化钠,B是碳酸钠,C是碳酸氢钠。因此B转化为C的离子方程式为CO32-+CO2+H2O=2HCO3- 。
(5)(5)若D为氯碱工业的主要产品,B具有两性,则A是铝盐,B是氢氧化铝,D是氢氧化钠,C是偏铝酸钠。所以C溶液中除氢氧根外还存在的阴离子的化学式为AlO2-。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则A是金属氧化物,B是CO2,D是碳,C是CO。CO2是含有极性键的共价化合物,结构式是O=C=O。
(7)若A、B、C均能使湿润的pH试纸变红,且相同条件下颜色依次加深,说明相应的酸性依次增强,所以A是硫化氢,B是SO2,C是三氧化硫,D是氧气。由于亚硫酸盐极易被氧化生成硫酸盐,所以反应的方程式可以是2NH4HSO3+O2=2NH4HSO4。
