高锰酸钾是锰的重要化合物和常用的氧化剂,工业用软锰矿制备高锰酸钾的实验流程如下:
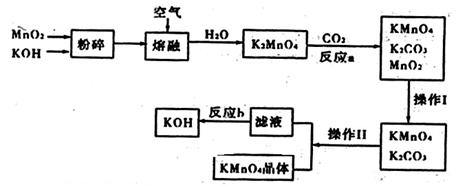
(1)上述流程中可以循环使用的物质有 (写化学式)
(2)从经济环保角度考虑,要完全反应b需要的试剂最好是 ,并写出相应的化学方程式 。
(3)高锰酸钾是氧化还原滴定分析时常用的一种试剂,在滴定操作时,应将高锰酸钾标准溶液盛放在 (填“酸式”或“碱式”)滴定管中,用酸性KMnO4溶液滴定硫酸亚铁晶体(FeSO4•7H2O)溶液, 写出滴定反应的离子方程式 。
(4)KMnO4、双氧水、活性炭常用于饮用水的处理,但三者在联合使用时必须有先后顺序。①氧化反应:H2O2 - 2e- → 2H+ + O2↑;还原反应:MnO4- + 5e- + 8H+ → Mn2+ + 4H2O
写出该氧化还原反应的化学方程式 。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投放,否则会发生KMnO4+ C+ H2O→MnO2 + X + K2CO3(未配平),其中X的化学式为 。
(1)MnO2 KOH (2)生石灰或熟石灰(CaO 或 CaOH)
CaO+H2O+K2CO3=2KOH+CaCO3↓ 或Ca(OH)2+K2CO3=2KOH+CaCO3↓
(3) 酸式 5Fe2++MnO4-+8H+=5Fe3++Mn2++4H20
(4)①5H2O2+2KMnO4+3H2SO4=K2SO4+2K2SO4+2MnSO4+5O2↑+8H2O②KHCO3
题目分析:流程图中发生两个反应:2MnO2+4KOH+O2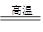 2KMnO4+2H2O、3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,操作I过滤出MnO2可循环使用、操作II分离出KMnO4晶体,滤液为K2CO3溶液,反应b为K2CO3生成KOH,生成的KOH可循环使用。反应b中另一反应物可为氢氧化钙或氢氧化钡,从环保角度考虑最好用氢氧化钙或氧化钙。(3)高锰酸钾溶液具有强氧化性,应盛放在酸式滴定管中,酸性高锰酸钾溶液氧化Fe2+生成Fe3+,同时MnO4-被还原为Mn2+。(4)将氧化反应和还原反应相加,消去电子即得反应离子方程式,再将离子方程式改为化学方程式。配平方程式时,先根据得失电子相等配平,再根据原子守恒配平。
2KMnO4+2H2O、3K2MnO4+2CO2=2KMnO4+MnO2+2K2CO3,操作I过滤出MnO2可循环使用、操作II分离出KMnO4晶体,滤液为K2CO3溶液,反应b为K2CO3生成KOH,生成的KOH可循环使用。反应b中另一反应物可为氢氧化钙或氢氧化钡,从环保角度考虑最好用氢氧化钙或氧化钙。(3)高锰酸钾溶液具有强氧化性,应盛放在酸式滴定管中,酸性高锰酸钾溶液氧化Fe2+生成Fe3+,同时MnO4-被还原为Mn2+。(4)将氧化反应和还原反应相加,消去电子即得反应离子方程式,再将离子方程式改为化学方程式。配平方程式时,先根据得失电子相等配平,再根据原子守恒配平。
点评:钡离子是重金属离子,可溶性钡盐有毒。如透视用的钡餐是硫酸钡的悬浊液,不能用碳酸钡的悬浊液,因碳酸钡与胃酸生成氯化钡有剧毒。
