(16分). 在某澄清、透明的黄色溶液中,可能含有NH4+、Fe3+、Ba2+、Al3+、SO42-、HCO3-、I- Cl-离子。进行下述实验(所加试剂均过量)。
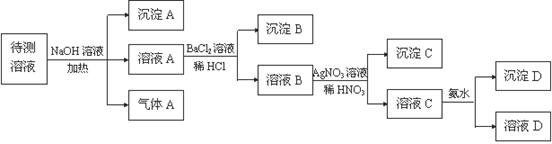
(1) 沉淀 A的化学式是 ,气体A的化学式是 ;
(2)待测液中一定存在 ;一定不存在 _______ 用离子方程式表示上述离子一定不存在的原因 。
(3)写出溶液C与过量氨水反应的离子方程式 。
(4)若气体A、沉淀A、沉淀D的物质的量各为1mol,则SO42-的物质的量为: mol
(1)Fe(OH)3 (1分) NH3(1分)(2)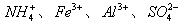 (2分)
(2分)
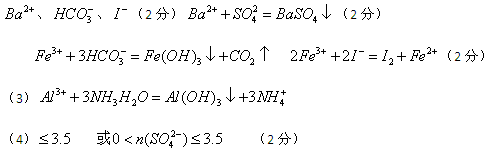
溶液显黄色,所以一定含有铁离子。铁离子具有氧化性,能氧化碘离子生成单质碘。同时也能和HCO3-相互水解生成氢氧化铁和CO2,所以就一定不能含有HCO3-、I-。加入过量的氢氧化钠生成沉淀,所以该沉淀一定是氢氧化铁。气体应该是氨气,因此一定含有NH4+。溶液A能和盐酸酸化的氯化钡反应生成白色沉淀,所以该沉淀是硫酸钡,因此一定含有SO42-,则就一定没有Ba2+。溶液B中含有氯离子,生成沉淀C是氯化银,但由于前面用盐酸酸化,所以不能确定是否含有氯离子。溶液C能和过量的氨水反应生成沉淀,所以该沉淀只能是氢氧化铝,即原溶液中还含有Al3+。若气体A、沉淀A、沉淀D的物质的量各为1mol,则溶液中阳离子的电荷数是7mol,由于不能排除氯离子,所以SO42-的物质的量应该是小于等于3.5mol。
