(13分)(1)利用反应6NO2+8NH3 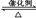 7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理大气中的污染物NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是 L。
已知:2SO2(g)+O2(g)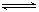 2SO3(g) ΔH="-196.6" kJ·mol-1
2SO3(g) ΔH="-196.6" kJ·mol-1
2NO(g)+O2(g)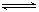 2NO2(g) ΔH="-113.0" kJ·mol-1
2NO2(g) ΔH="-113.0" kJ·mol-1
则反应NO2(g)+SO2(g)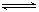 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(2)物质A~E都是中学化学中常见的物质,它们可发生如图所表示的反应:
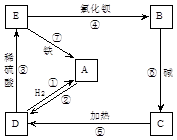
在以上反应中(用序号填空):属于氧化还原反应的是 ;属于复分解反应的是 。反应③的离子方程式为 :
若以反应⑦设计一个原电池,则原电池的负极材料应为 。
(1)6.72 -41.8 (2)①②⑦;③④⑤ CuO+2H+=Cu2++H2O 铁
题目分析:(1)根据反应6NO2+8NH3 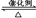 7N2+12 H2O可知,6molNO2参加反应转移24mol电子,因此转移1.2mol电子发生反应的NO2为0.3mol,体积为6.72L。根据盖斯定律知
7N2+12 H2O可知,6molNO2参加反应转移24mol电子,因此转移1.2mol电子发生反应的NO2为0.3mol,体积为6.72L。根据盖斯定律知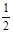 (①-②)得目标反应,因此ΔH=
(①-②)得目标反应,因此ΔH=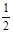 (-196.6 kJ·mol-1+-113.0 kJ·mol-1)=-41.8 kJ·mol-1。
(-196.6 kJ·mol-1+-113.0 kJ·mol-1)=-41.8 kJ·mol-1。
(2)根据图示可知A为Cu,B为CuCl2,C为Cu(OH)2,D为CuO,E为CuSO4。所以属于氧化还原反应的为①②⑦,属于复分解反应的为③④⑤,反应③的离子方程式为:CuO+2H+=Cu2++H2O,反应⑦为Fe+Cu2+=Fe2++Cu,所以铁做负极材料。
点评:本题综合性强,但是考点比较基础,是高考的热点习题。
