某化学活动小组探究金属的反应规律.
○加入等质量和等质量分数的稀硫酸,甲中反应方程式为______.
(1)若比较镁和铁的金属活动性,观察到的现象是______;
(2)若比较相同时间内镁、铁与稀硫酸反应放出热量的多少,长颈漏斗中的现象是______;
(3)若实验所用的金属均过量,则甲装置中产生的H2的质量______(填“大于”、“小于”或“等于”)乙装置中产生的H2质量.
[探究二]在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生.下列判断正确的是______.
A.滤出的固体中一定含有铜
B.滤出的固体可能含有铁和镁
C.滤液中可能含有硫酸铜
D.滤液中一定含有硫酸镁和硫酸亚铁.
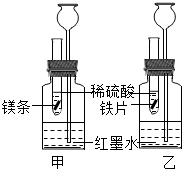
[探究一]
镁和硫酸反应生成硫酸镁和氢气;
故答案为:
Mg+H2SO4=MgSO4+H2↑;
(1)镁的活动性大于铁,因此,镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快;
故答案为:
镁和稀硫酸产生气泡的速率比铁和稀硫酸产生气泡的速率快;
(2)金属活动性越强,与酸反应越剧烈;镁的活动性大于铁,单位时间内镁比铁反应产生气体多,金属与酸反应放热,镁与酸反应放出热量多,长颈漏斗的液面上升的高;
故答案为:
甲装置长颈漏斗中的液面比乙装置中的高;
(3)镁、铁与硫酸反应生成氢气的质量=硫酸中氢元素的质量;由题意可知:所用的金属均过量,说明稀硫酸中的硫酸溶质全部参加反应,而甲、乙装置中所加的稀硫酸是等质量和等质量分数,所以两装置中硫酸质量相等,则硫酸所含氢元素的质量相等,生成氢气的质量相等;
故答案为:等于;
[探究二]
A、根据金属活动顺序表知镁比铁活泼,铁比铜活泼,所以加入镁粉,首先镁粉和氯化铜溶液反应,置换出单质铜,所以滤出的固体中一定含有铜,故A正确;
B、根据题意,向滤出的固体中滴加稀硫酸,没有气泡产生,说明固体中一定不含铁和镁,故B错误;
C、因为加入的是一定量的镁粉,由B可知:镁粉不足,可能硫酸铜剩余,故C正确;
D、由于,首先镁粉参与反应,所以滤液中一定有硫酸镁,固体中无铁,说明硫酸亚铁未反应,所以滤液中也一定有硫酸亚铁,故D正确;
故选ACD.
