铝是一种重要金属,从铝土矿(主要成分为Al2O3,Fe2O3、SiO2等)中冶炼Al的工业生产流程如下图:
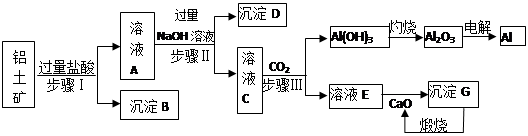
(1)沉淀B的化学式为 ,溶液A中含的阳离子主要有 。
(2)写出步骤II生成溶液C 的离子方程式 ,
步骤I、II、III都要用到的分离方法是 。
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有: (填化学式)。
(4)生产中曾用铝热反应焊接钢轨,则铝与氧化铁发生反应的化学方程式为:
(5)经分析,a吨铝土矿可以冶炼出b吨的铝(假设各生产环节中无损耗),则原铝土矿中Al2O3的纯度(质量分数) (用含a、b的最简式表示)。
12分)(1) SiO2 (1分); Al3+、Fe3+、H+ (2分,有错不得分,漏选得1分)
(2)Al3++4OH-=[Al(OH)4]- (2分) 过滤 (1分)
(3)CO2、NaOH (2分)
(4)2Al+ Fe 2O3 高温 Al 2O3 + 2Fe (2分)
( 5) 17b/9a 或 (17b/9a)*100% (2分)
题目分析:(1)二氧化硅和盐酸不反应,所以沉淀B是二氧化硅,溶液A中含有H+、Al3+、Fe3+。
(2)加入过量的烧碱则生成氢氧化铁沉淀,而溶液C是偏铝酸钠和氢氧化钠的混合液。步骤II生成溶液C 的离子方程式为Al3++4OH-=[Al(OH)4]-。步骤I、II、III都要用到的分离方法是过滤。
(3)生产过程中,除CaO可以循环使用外,还可以循环使用的物质有CO2、NaOH。
(4)铝热反应的方程式为2Al+ Fe 2O3 高温 Al 2O3 + 2Fe。
( 5) Al2O3中Al的质量分数为:9/17或(9/17)*100%,故原铝土矿中Al2O3的纯度(质量分数)为17b/9a 或 (17b/9a)*100%。
向D中通入过量的CO2,则生成碳酸氢钠和氢氧化铝白色沉淀。氢氧化铝不稳定,加热分解生成氧化铝和水。电解熔融的氧化铝则生成单质铝。
点评:本题以框图题形式考查铝的化合物的性质,难度中等,清楚提取的操作过程原理,是对知识迁移的综合运用。
