A、B、C、D均为中学化学中常见的物质,它们之间转化关系如下图(部分产物已略去):试回答:
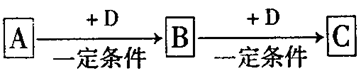
(1)若D是具有氧化性的单质,则属于主族的金属A为 ________ (填元素符号),C的电子式为__________
(2)若A是某物质的稀溶液,D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)____________;D在潮湿的空气中易发生 吸氧腐蚀,写出腐蚀时原电池正极的电极反应式___________。
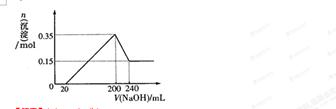
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B。请写出B转化为C的所有可能的离子方程式_____________________。化合物B经过一系列反应可以得到单质E,将一定质量的Mg和E 的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如右图所示。则固体混合物中Mg的质量为________;NaOH溶液的物质的量浓度为 ________。硫酸溶液的物质的量浓度为_______。
(1)Na 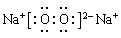
(2)加入少量铁,防止被氧化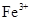 ;2Fe3++Fe=3Fe2+;O2+4e-+2H2O=4OH-
;2Fe3++Fe=3Fe2+;O2+4e-+2H2O=4OH-
(3)Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH-=AlO2-+2H2O
3.6g ;5.0mol/L ;1.0mol/L
题目分析:(1)若D是具有氧化性的单质,则根据物质的转化关系以及转化特点可知,属于主族的金属A为Na,则B是氧化钠,C就是过氧化钠。过氧化钠是含有离子键和非极性键的离子化合物,其电子式为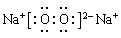 。
。
(2)若A是某物质的稀溶液,D是金属,所以根据转化的关系以及转化特点可判断D应该是变价金属铁,B是含有铁离子的盐,C是含有亚铁离子的盐。由于亚铁离子易被氧化生成铁离子,所以C溶液在储存时应加入少量铁,目的是为了防止亚铁离子被氧化,反应的方程式是2Fe3++Fe=3Fe2+。钢铁在发生吸氧腐蚀时,铁是负极,失去电子,氧气在正极得到电子,所以正极电极反应式是O2+4e-+2H2O=4OH-。
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C反应生成B,这说明三种化合物都含有铝元素,其中B是氢氧化铝。如果D是酸,则A就是偏铝酸盐,C是铝盐。如果D是碱,则A就是铝盐,C是偏铝酸盐,所以B转化为C的所有可能的离子方程式Al(OH)3+3H+=Al3++3H2O、Al(OH)3+OH-=AlO2-+2H2O。E是单质铝,根据图像可知,加入氢氧化钠溶液后并没有立即生成沉淀,这说明稀硫酸是过量的,所以有关的方程式是H++OH-=H2O、Al3++3OH-=Al(OH)3↓、Mg2++2OH-=Mg(OH)2↓、Al(OH)3+OH-=AlO2-+2H2O。根据图像可知,和氢氧化铝反应的氢氧化钠溶液是240ml-200ml=40ml,则氢氧化铝的物质的量是0.35mol-0.15mol=0.20mol,氢氧化镁是0.15mol,所以混合物镁质量是0.15mol×24g/mol3.6g;氢氧化钠溶液的物质的量浓度是0.2mol÷0.04L=5.0mol/L。当沉淀质量达到最大值时溶液中就只有硫酸钠,产生氢氧化钠的物质的量是0.2L×5mol/L=1mol,因此根据原子守恒可知,硫酸钠的物质的量是0.5mol,则硫酸钠的浓度是0.5mol÷0.5L=1.0mol/L。
点评:该题是高考中的常见题型和考点,属于中等难度的试题。试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和灵活应变能力。在进行无机框图题的判断时应该注意的是化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。该题的计算关键是明确反应原理,然后依据方程式和图像灵活运用即可。
