下表为元素周期表的一部分:
| 族 周期 | ||||||||
| 1 | ① | |||||||
| 2 | ② | |||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ||||
(1)写出元素④在周期表中的位置______________。
(2)②、③、⑤的原子半径由大到小的顺序为_________________________。
(3)④、⑤、⑥的气态氢化物的稳定性由强到弱的顺序是_________________________。
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
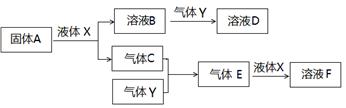
(1)写出固体A与液体X反应的离子方程式 。
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D的溶质为 (填化学式)。已知溶液D显酸性,则D溶液中各种离子浓度由大到小的顺序为
(3)写出气体C与气体Y反应的化学方程式 。
(14分)
Ⅰ.(1)第四周期第ⅣA族(1分)
(2)Na>S>O(2分)
(3)HCl>H2S>SiH4(2分)
(4) 或
或 (2分)
(2分)
Ⅱ.(1)2Na2O2 +2H2O = 4Na+ + 4OH― + O2↑(2分)
(2)NaHSO3(1分)
c(Na+)> c(HSO3-) > c(H+) > c(SO32-) > (OH-)(2分)
(3)2SO2 +O2 2SO3(2分)
2SO3(2分)
题目分析:根据元素所在周期表中的位置,可知元素的种类,①为H元素,②为O元素,③为Na元素,④为Si元素,⑤为S元素,⑥为Cl元素,
Ⅰ.⑴④为Si元素,在周期表中的位置第四周期第ⅣA族;答案:第四周期第ⅣA族。
⑵电子层越多半径越大,电子层数一样的,质子数越小,半径越大,③为Na元素,⑤为S元素,同一周期,Na>S,②为O元素,⑤为S元素,同一主族,S>O,②、③、⑤的原子半径由大到小的顺序为:Na>S>O,答案:Na>S>O;
⑶同周期元素从左到右元素的非金属性逐渐增强,同主族元素从上到下元素的非金属性逐渐减弱,元素的非金属性越强,对应氢化物越稳定,Cl、S、Si,同一周期,所以④、⑤、⑥的气态氢化物的稳定性由强到弱的顺序是:HCl>H2S>SiH4;答案:HCl>H2S>SiH4;
⑷H、O、Na、Cl中的某些元素可形成既含离子键又含极性共价键的化合物有多种:如:NaOH、NaClO等,电子式为 或
或 ,答案:
,答案: 或
或 。
。
Ⅱ.A是一种淡黄色固体,A是Na2O2,气体Y是一种大气污染物,直接排放会形成酸雨,Y为SO2,推出:A、Na2O2 B、NaOH C、O2 D、NaClO E、SO3 F、H2SO4 X、H2O Y、SO2
(1)Na2O2和水反应:2Na2O2 +2H2O = 4Na+ + 4OH― + O2↑答案:2Na2O2 +2H2O = 4Na+ + 4OH― + O2↑;
(2)当NaOH与SO2物质的量之比为1:1且恰好完全反应时,NaOH+SO2=NaHSO3,所得溶液D的溶质为NaHSO3,HSO3―的电离多于水解,所以溶液呈酸性,溶液中各种离子浓度由大到小的顺序为:c(Na+)> c(HSO3-) > c(H+) > c(SO32-) > (OH-),答案:NaHSO3、c(Na+)> c(HSO3-) > c(H+) > c(SO32-) > (OH-)
(3)气体SO2与气体O2反应的化学方程式 ;2SO2 +O2 2SO3,答案:2SO2 +O2
2SO3,答案:2SO2 +O2 2SO3。
2SO3。
