在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题:

(1)在反应②中,每生成 2.24L 气体G(标准状况)时,该反应转移电子的物质的量是 mol。
(2)若反应①在加热条件下进行,单质A和化合物B按物质的量之比为1:2发生反应,且C、D是两种均能使澄清的石灰水变浑浊的无色气体,则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一元强碱,B是一种酸式盐,D是一 种使湿润红色石蕊试纸变蓝的气体,且B遇盐酸能生成使品红溶液褪色的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
( 4)由金红石(TiO2)制取单质Ti,涉及到的步骤为:TiO2→TiCl4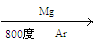 Ti
Ti
①C(s) + O2(g) = CO2(g); △H = -393.5 kJ•mol-1
②2CO(g) + O2(g) = 2CO2(g); △H = -566 kJ•mol-1
③TiO2(s) + 2Cl2(g) = TiCl4(s) + O2(g); △H =" +141" kJ•mol-1
则TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g) 的△H = _________________。
(1)0.2 (2)C+2H2SO4(浓) CO2↑+2SO2↑+2H2O.
CO2↑+2SO2↑+2H2O.
(3) NH4++HSO3-+2OH- NH3↑+2H2O+SO32-. (4)△H=—80KJ/mol.
NH3↑+2H2O+SO32-. (4)△H=—80KJ/mol.
题目分析:(1)根据题意可知:E、F、G、H分别是E:H2O;F:Na2O2;G: O2;H: NaOH. 反应②的方程式是2H2O+2 Na2O2= O2↑+NaOH. 可见每产生1mol的氧气,转移电子2mol.现在生成O2体积是2.24L ,奇0.1mol,所以转移电子0.2mol.(2)根据题意可知:A:C;B:浓H2SO4;C:CO2;D:SO2。反应①的化学方程式是C+2H2SO4(浓) CO2↑+2SO2↑+2H2O.(3)根据题意可知:A:NaOH;B:NH4HSO3;C:H2O;D:NH3。E:Na2SO3. 在加热条件下,当A过量时,反应①的离子方程式NH4++HSO3-+2OH-
CO2↑+2SO2↑+2H2O.(3)根据题意可知:A:NaOH;B:NH4HSO3;C:H2O;D:NH3。E:Na2SO3. 在加热条件下,当A过量时,反应①的离子方程式NH4++HSO3-+2OH- NH3↑+2H2O+SO32-.①×2-②+③可得:TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g)△H =—80KJ/mol.
NH3↑+2H2O+SO32-.①×2-②+③可得:TiO2(s) + 2Cl2(g) + 2C(s)= TiCl4(s) + 2CO(g)△H =—80KJ/mol.
