甲、乙两组同学探究金属的化学性质,做了以下实验:
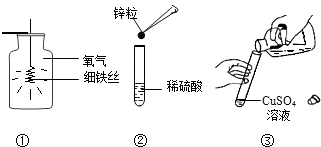
甲组:①铁丝在氧气中燃烧 ②锌与稀硫酸反应 ③铝丝与硫酸铜溶液反应
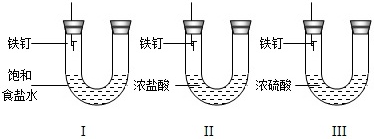
乙组:探究铁的锈蚀条件
(1)甲组中共有______处操作错误,写出③中发生反应的化学方程式______;
(2)甲组实验完毕后,将剩余物倒入废液缸中,测得废液显酸性并含有Cu2+,为将其溶液变为中性并回收铜,应选择的一种试剂是______(填序号)
A.碳酸钠 B.铁粉 C.银粉 D.氢氧化钙
(3)一星期后观察Ⅰ、Ⅱ、Ⅲ的现象,
A.装置Ⅰ中铁钉一侧的液面一定会上升
B.装置Ⅰ、Ⅱ、Ⅲ中的铁钉都被腐蚀
C.装置Ⅰ比装置Ⅱ的铁钉一侧的液面低
你认为上述正确的是______(填序号).
(1)甲图Ⅰ中没有在瓶底预留少量水防止生成物熔化溅落使集气瓶底炸裂,错误;Ⅱ中应该先放锌粒后放稀硫酸;Ⅲ中瓶塞应倒放,所以正放错误.(2)加入铁粉后,与稀硫酸反应生成硫酸亚铁和氢气,使溶液变为中性;铁排在铜的前面,所以铁可以把废液中Cu2+置换出来生成铜.(3)Ⅰ中铁钉在水和氧气的条件下生锈,使得铁钉一侧的压强减小液面一定会上升,故A正确
Ⅱ中浓盐酸具有挥发性,挥发出的氯化氢气体可以和铁钉反应生成氢气,铁钉一侧的压强变大液面一定会下降,故C错误.Ⅲ中浓硫酸能吸收水做干燥剂,所以铁钉不会生锈,故B错误.
故答案为:(1)3、2Al+3CuSO4=Al2(SO4)3+3Cu (2)B (3)A
