(12分)
Ⅰ.短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17g·L-1;常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol·L-1 Z的水溶液pH=13。X2、Y 和Z之间有如下转化关系(其他无关物质已略去)
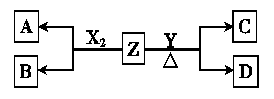
 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式
(2)已知C能与硫酸反应生成能使品红溶液褪色的气体
①D的化学式是 ;D的水溶液pH>7,原因是(用离子方程式表示)
②将20mL 0.5mol·L-1 C溶液逐滴加入到20 mL 0.2mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。写出反应的离子方程式
Ⅱ.下表是元素周期表的一部分,表中所列的字母分别代表某一元素.
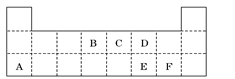
某种金属元素的单质G,可以发生如下图所示转化:

其中化合物M是一种白色胶状沉淀;K的溶液与过量B的某种氧化物反应的化学方程式为___________________________;一种新型无机非金属材料由G元素和C元素组成,其化学式为 。
Ⅰ.(1) Cl2 + 2OH– = Cl– + ClO– + H2O
(2) ① K2S S2– + H2O  HS– + OH–
HS– + OH–
② 5SO32– + 2MnO4– + 6H+ = 5SO42 – + 2Mn2+ + 3H2O
Ⅱ.NaAlO2 + CO2 + 2H2O = NaHCO3 + Al(OH)3↓ AlN
题目分析:Ⅰ.M(X2) = 3.17g·L-1×22.4L·mol–1 =" 71" g·mol–1,所以X为氯元素,常温下,短周期元素Y的单质为淡黄色固体,则Y为硫元素,Z的焰色反应呈浅紫色,说明Z中含有钾元素,0.1mol·L-1 Z的水溶液pH=13说明Z为强碱,即Z为KOH。由X2、Y 和Z之间的转化关系图可知X2与Z的反应为:Cl2 + 2KOH =" KCl" + KClO + H2O,Y 和Z在加热条件下的反应为:3S + 6KOH = K2S + 2K2SO3 + 3H2O。综上所述可得:(1) 写出常温下单质X2与Z反应的离子方程式:Cl2 + 2OH– = Cl– + ClO– + H2O (2)C为K2SO3,与硫酸反应生成SO2使品红溶液褪色,则D为K2S。①D的化学式为K2S;其水溶液pH>7,是因为S2–水解呈碱性,水解的离子方程式为:S2– + H2O  HS– + OH–;②n(K2SO3)= 0.02L×0.5mol·L–1 = 0.01mol,n(KMnO4) = 0.02L×0.2mol·L-1 = 0.004mol,n(K2SO3):n(KMnO4) =5:2,酸性KMnO4具有强氧化性,能把氧化为SO42–,本身被还原为MnO4–,则配平后的离子方程式为:5SO32– + 2MnO4– + 6H+ = 5SO42 – + 2Mn2+ + 3H2O。
HS– + OH–;②n(K2SO3)= 0.02L×0.5mol·L–1 = 0.01mol,n(KMnO4) = 0.02L×0.2mol·L-1 = 0.004mol,n(K2SO3):n(KMnO4) =5:2,酸性KMnO4具有强氧化性,能把氧化为SO42–,本身被还原为MnO4–,则配平后的离子方程式为:5SO32– + 2MnO4– + 6H+ = 5SO42 – + 2Mn2+ + 3H2O。
Ⅱ.金属单质G能与NaOH溶液反应,则G为铝元素,从元素周期表中所列元素的位置可知,B为碳元素,C为氮元素,F为氯元素,又从有关物质的转化关系图可知,K为偏铝酸钠,L为氯化铝,K为氢氧化铝。故NaAlO2与CO2反应的化学方程式为:NaAlO2 + CO2 + 2H2O = NaHCO3 + Al(OH)3↓;铝与氮元素形成化合物时,铝显+3价,氮为–3价,其化学式为AlN。
