已知A是生产生活中用量最大的金属,B为淡黄色粉末。在常温下C为无色液体,E、G、H、I、J为气体,其中H为黄绿色,其它为无色。J能使湿润的红色石蕊试纸变蓝(图中部分产物已略去)。
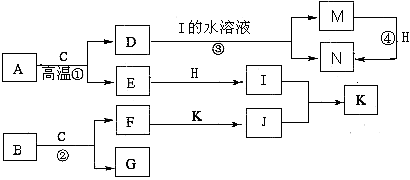
请填写下列空白
(1)写出化学式:D ,K 。
(2)写出②的离子方程式 。
(3)反应④不属于下列何种反应类型 (填字母序号)。
A.化合反应 B.氧化还原反应 C.离子反应 D.置换反应
(4)若要确定③反应后所得溶液中含有M物质,所选试剂为 (填序号)。
A.KSCN溶液和氯水 B.铁粉和KSCN
C.浓氨水 D.酸性高锰酸钾溶液
(5)将F加入到M的溶液里并露置在空气中,可以观察到整个过程的现象是:
。
(6)常温下,H与过量的J反应产生浓厚的白烟,另一生成物是空气的主要成分之一,请写出该反应的化学方程式 。
(1)Fe3O4,NH4Cl(2分,各1分)
(2)2Na2O2+2H2O =4Na++4OH—+O2↑(2分)
(3)D(1分)(4)D(3分)
(5)产生白色沉淀,迅速变成灰绿色,最后变成红褐色(2分)
(6)8NH3+3Cl2=N2+6NH4Cl(2分)
题目分析:(1)本题的突破口为题目所给物质的颜色和状态,根据这些信息可推出部分物质,然后根据框图推出其它物质。A是生产生活中用量最大的金属,为Fe,在常温下C为无色液体,则C为H2O,B为淡黄色粉末,能与H2O反应,则B为Na2O2,H为黄绿色,H为Cl2,J能使湿润的红色石蕊试纸变蓝,则J为NH3,带入框图可得其他物质,D为Fe3O4、E为H2、F为NaOH、G为O2、I为HCl、K为NH4Cl、M为FeCl2、N为FeCl3。
(2)②为Na2O2与H2O反应生成NaOH和O2,进而得出离子方程式。
(3)反应④为:Cl2+2FeCl2=2FeCl3,该反应属于化合反应、氧化还原反应、离子反应,但不属于置换反应。
(4)反应③为Fe3O4与HCl反应生成FeCl2和FeCl3,要检验FeCl2,利用FeCl2的还原性,能使酸性KMnO4溶液褪色进行检验。
(5)把NaOH加入到FeCl2溶液中,首先生成Fe(OH)2,然后Fe(OH)2与O2、H2O反应生成Fe(OH)3,故反应现象为:产生白色沉淀,迅速变成灰绿色,最后变成红褐色。
(6)Cl2与过量的NH3反应,产生的浓厚的白烟为NH4Cl,另一生成物是空气的主要成分,为N2,配平可得化学方程式:8NH3+3Cl2=N2+6NH4Cl。
