A、B、C、D、E五种物质均含有同一种元素,它们之间有如下转化关系:
(1)若A为单质,B、C均属于盐类,B的水溶液呈酸性,C的水溶液呈碱性,D是一种白色沉淀。写出下列过程的离子方程式:
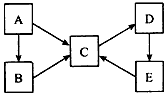
①B的水溶液呈酸性____________。 ②C→D_______________。 ③E→C________________。
(2)若A~E均为化合物。A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法。
①A的电子式为__________。
②电解D的水溶液时,反应的离子方程式为________________。
③生铁浸入D溶液而发生锈蚀,正极的电极反应为________________。
(3)若A为单质,C、D的相对分子质量相差16,0.1mol/L E溶液中只有3种离子,且常温下溶液中的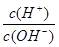 =1012。
=1012。
①B→C的化学方程式为: 。
②A→C的反应中,每转移1 mol e-就会吸热45 kJ,写出该反应的热化学方程式: 。
(1)①Al3++3H2O  Al(OH)3+3H+; ②AlO2-+H++H2O=Al(OH)3↓ ③Al2O3+2OH-=2AlO2-+H2O
Al(OH)3+3H+; ②AlO2-+H++H2O=Al(OH)3↓ ③Al2O3+2OH-=2AlO2-+H2O
(2)①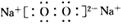 ; ②2Cl-+2H2O
; ②2Cl-+2H2O H2↑+Cl2↑+2OH-; ③O2+4e-+2H2O=4OH-
H2↑+Cl2↑+2OH-; ③O2+4e-+2H2O=4OH-
(3)①4NH3+5O2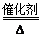 4NO+6H2O ②N2(g)+O2(g)=2NO(g) △H="+180" kJ/mol
4NO+6H2O ②N2(g)+O2(g)=2NO(g) △H="+180" kJ/mol
题目分析:(1)根据题意可推知:A:Al ; B:AlCl3; C:NaAlO2; D:Al(OH)3; E:Al2O3.①B的水溶液呈酸性是因为AlCl3是强酸弱碱盐,弱碱根离子水解消耗了水电离产生的OH-,最终当溶液达到平衡时,C(H+)>C(OH-).水解的离子方程式为:Al3++3H2O  Al(OH)3+3H+ ②C→D AlO2-+H++H2O=Al(OH)3↓③E→C Al2O3+2OH-=2AlO2-+H2O
Al(OH)3+3H+ ②C→D AlO2-+H++H2O=Al(OH)3↓③E→C Al2O3+2OH-=2AlO2-+H2O
(2) 若A~E均为化合物。A是淡黄色固体;B、C两溶液在等物质的量浓度时,C 溶液的pH较小。电解D的水溶液是最重要的工业生产之一,D→E→C也是工业制备C的普遍方法。 则个物质分别是:A :Na2O2; B :NaOH; C :Na2CO3;D : NaCl;E :NaHCO3. ①Na2O2的电子式为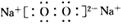 .②电解饱和NaCl的水溶液的离子方程式为2Cl-+2H2O
.②电解饱和NaCl的水溶液的离子方程式为2Cl-+2H2O H2↑+Cl2↑+2OH-;③生铁浸入NaCl溶液而发生的是吸氧腐蚀,正极的电极反应为O2+4e-+2H2O=4OH-,正极的电极式为Fe-2e-=Fe2+.
H2↑+Cl2↑+2OH-;③生铁浸入NaCl溶液而发生的是吸氧腐蚀,正极的电极反应为O2+4e-+2H2O=4OH-,正极的电极式为Fe-2e-=Fe2+.
(3)若A为单质,C、D的相对分子质量相差16,0.1mol/L E溶液中只有3种离子,且常温下溶液中的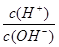 =1012。则A:N2;B:NH3;C:NO;D:NO2;E:HNO3。①B→C的化学方程式为:4NH3+5O2
=1012。则A:N2;B:NH3;C:NO;D:NO2;E:HNO3。①B→C的化学方程式为:4NH3+5O2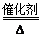 4NO+6H2O②A→C的反应的热化学方程为:N2(g)+O2(g)=2NO(g) △H="+180" kJ/mol。
4NO+6H2O②A→C的反应的热化学方程为:N2(g)+O2(g)=2NO(g) △H="+180" kJ/mol。
