我国濒临海域的省份,能够充分利用海水制得多种化工产品。如图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。
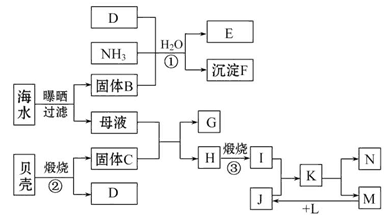
结合上述工艺流程回答下列问题:
(1)物质G和L的化学式分别为___________________和___________________。
(2)上述工艺流程中可以循环使用的物质的化学式为______________________。
(3)反应①的化学方程式为____________;在反应①中必须先通入NH3,而后通入D,其原因是_______________________________________________________。
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为____________。
(5)由K溶液经如何处理才能制得N?_________________________________________________________。
(1)CaCl2 H2 (2)CO2
(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl
NH3在溶液中的溶解度大,利于吸收CO2,使其转化为NH4HCO3
(4)2NaHCO3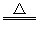 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融电解可制取金属镁
解答本题应注意以下两点:
(1)联系与海水综合利用相关的工业生产分析工艺流程图。
(2)明确工艺流程图中各字母对应的物质。
题中的工艺流程图由海水晒盐、海水提镁和工业制纯碱三部分组成。分析工艺流程图中的转化关系可得,B、C、D、E、F、G、H、I、J、K、L、M、N分别是NaCl、CaO、CO2、NH4Cl、NaHCO3、CaCl2、Mg(OH)2、MgO、HCl、MgCl2、H2、Cl2、Mg。
(1)物质G和L的化学式分别为CaCl2、H2。
(2)在用贝壳制生石灰时同时生成CO2,在将NaHCO3加热分解制纯碱时也生成CO2,CO2可循环利用。
(3)反应①是用NaCl、NH3、CO2和H2O反应制取NaHCO3和NH4Cl的反应,化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。NH3在水溶液中的溶解度大,利于吸收较多量的CO2使其转化为NH4HCO3。
(4)工业上用NaHCO3受热分解可制得纯碱,化学方程式为:2NaHCO3 Na2CO3+
Na2CO3+
CO2↑+H2O。
(5)MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得无水MgCl2,再电解熔融MgCl2可制得金属镁。
