已知X为中学化学中的一种常见的盐,F为淡黄色固体;M、N为常见的金属,N的最高价氧化物是耐火材料;H为气体单质,D为无色气体,在空气中会出现红棕色。各物质的转化关系如下图(部分反应产物已略去)。
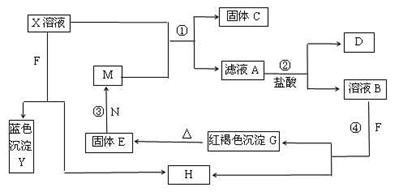
请回答下列问题:
(1)X的化学式为 。
(2)在反应①②③④中属于置换反应的是 (填序号)。
(3)反应③的化学方程式为_________________________________。
(4)X溶液与F反应的总化学方程式为 。
(5)检验滤液A中金属离子的方法是 。
(6)若向100 mL盐X的溶液中加入10 g过量金属单质M的粉末,充分搅拌后,过滤,烘干得10.16g固体。则滤液A中溶质的物质的量浓度为_________。(假设溶液体积不变)
(1)Cu(NO3)2 (2)①③
(3)Fe2O3 + 2Al  Al2O3 + 2Fe
Al2O3 + 2Fe
(4)2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑
(5)取少量滤液A加入NaOH溶液,产生白色沉淀,沉淀变成灰绿色最后变成红褐色
(6)0.2 mol/L
题目分析:F为淡黄色固体,应为Na2O2,蓝色沉淀Y为Cu(OH)2,N的最高价氧化物是耐火材料,它的晶体硬度很大,常做手表的轴承,应为Al2O3,则N为Al,过氧化钠与水反应生成的H为O2,D为无色气体,在空气中会出现红棕色,则D为NO,说明X为Cu(NO3)2,由A→D生物反应可知A中含有Fe2+,则M为Fe,C为Cu,G应为Fe(OH)3,E为Fe2O3,(1)由以上分析可知X为Cu(NO3)2,故答案为:Cu(NO3)2;(2)根据题中反应转化关系可知,反应①③都有单质参加和生成,为置换反应,②④没有单质生成,肯定不是置换反应,故答案为:①③;(3)反应③是铝热反应,化学方程式为Fe2O3 + 2Al  Al2O3 + 2Fe 。(4)Cu(NO3)2溶液与Na2O2反应的总化学方程式为2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑,故答案为:2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑;(5)反应为Fe+Cu2+=Cu+Fe2+,n(Fe)=10/56=0.18mol,如全部生成Cu,n(Cu)=0.18mol×64g/mol=11.4mol,但得10.16g固体,说明Fe过量,则可用差量法计算,
Al2O3 + 2Fe 。(4)Cu(NO3)2溶液与Na2O2反应的总化学方程式为2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑,故答案为:2Na2O2+2Cu(NO3)2+2H2O=2Cu(OH)2+4NaNO3+O2↑;(5)反应为Fe+Cu2+=Cu+Fe2+,n(Fe)=10/56=0.18mol,如全部生成Cu,n(Cu)=0.18mol×64g/mol=11.4mol,但得10.16g固体,说明Fe过量,则可用差量法计算,
Fe+Cu2+=Cu+Fe2+ △m
1mol 8g
n 0.16g
n=0.02mol,c=0.02/0.1=0.2mol/L,故答案为:0.2 mol/L。
