已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系:
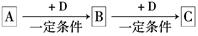
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
(2)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
(3)若D是一种常见的温室气体,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,固体C受热分解可得固体B,该反应的化学方程式是 。
(4)若D为氯碱工业的主要产品,B具有两性,则B转化为C的离子方程式为 。
(5)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则元素D在周期表中的位
置是 ,B分子的结构式为 。
(1)4NH3 + 5O2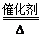 4NO + 6H2O(2)防止Fe2+被氧化,2F3+ + Fe = 3Fe2+(3)2NaHCO3
4NO + 6H2O(2)防止Fe2+被氧化,2F3+ + Fe = 3Fe2+(3)2NaHCO3 Na2CO3 + H2O +CO2↑(4)Al(OH)3 + OH- = AlO2- + 2H2O(5)第2周期、第ⅣA族,O=C=O
Na2CO3 + H2O +CO2↑(4)Al(OH)3 + OH- = AlO2- + 2H2O(5)第2周期、第ⅣA族,O=C=O
题目分析:A和D反应生成B,B和D反应生成C,则B和C中含有的某种共同元素是变价元素。
(1)若A能使湿润的红色石蕊试纸变蓝,则A是NH3,C为红棕色气体NO2,NH3和D能反应生成B,则B是NO,D是O2,A转化为B的反应方程式为4NH3+5O2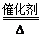 4NO+6H2O(2)D是金属,C溶液在贮存时应加入少量D,说明C易被氧化而变质,则A为Cl2,B为FeCl3,C为FeCl2,D为Fe,在亚铁离子溶液中加入的理由防止Fe2+被氧化,离子方程式2F3+ + Fe = 3Fe2+(3)若D是一种常见的温室气体,则D是二氧化碳,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,则A是NaOH,则B为Na2CO3,C为NaHCO3,B转化为C的离子方程式为CO2+CO32-+H2O=2HCO3-(4)D为氯碱工业的主要产品为NaOH,B具有两性推断为Al(OH)3;则C溶液是Al(OH)3和NaOH反应生成NaAlO2,离子方程式Al(OH)3 + OH- = AlO2- + 2H2O(5)若A、B、C均为氧化物,D是一种黑色固态非金属单质,推断为D为C,B为CO2,C为CO,则元素D在周期表中的位置是第2周期、第IVA族,B分子的结构式为O=C=O。
4NO+6H2O(2)D是金属,C溶液在贮存时应加入少量D,说明C易被氧化而变质,则A为Cl2,B为FeCl3,C为FeCl2,D为Fe,在亚铁离子溶液中加入的理由防止Fe2+被氧化,离子方程式2F3+ + Fe = 3Fe2+(3)若D是一种常见的温室气体,则D是二氧化碳,A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子,则A是NaOH,则B为Na2CO3,C为NaHCO3,B转化为C的离子方程式为CO2+CO32-+H2O=2HCO3-(4)D为氯碱工业的主要产品为NaOH,B具有两性推断为Al(OH)3;则C溶液是Al(OH)3和NaOH反应生成NaAlO2,离子方程式Al(OH)3 + OH- = AlO2- + 2H2O(5)若A、B、C均为氧化物,D是一种黑色固态非金属单质,推断为D为C,B为CO2,C为CO,则元素D在周期表中的位置是第2周期、第IVA族,B分子的结构式为O=C=O。
