问题
选择题
用某金属颗粒与足量的稀盐酸反应,如生成氢气的质量(以纵坐标表示,单位:g)与所用金属的质量(以横坐标表示,单位:g)之间的关系如图,该金属颗粒可能是( )
A.纯净的锌
B.含铜的锌
C.含有不与酸反应的杂质的铁
D.含有不与酸反应的杂质的锌
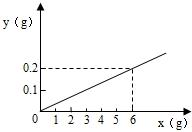
答案
A、设生成0.2g氢气需要金属锌的质量为x,
Zn+2HCl═ZnCl2+H2↑
65 2
x 0.2g
=65 x 2 0.2g
x=6.5g
故A错误;
B、根据A计算可以看出,产生0.2g氢气需要纯锌的质量是6.5g,铜不与酸反应生成氢气,则6g含铜的锌不可能生成0.2g氢气,故B错误;
C、设生成0.2g氢气需要金属铁的质量为y,
Fe+2HCl═FeCl2+H2↑
56 2
y 0.2g
=56 y
,y=5.6g2 0.2g
5.6g含有不与酸反应的杂质的铁能生成0.2g氢气,故C正确;
D、根据A计算可以看出,产生0.2g氢气需要纯锌的质量是6.5g,6g含有不与酸反应的杂质的锌不可能生成0.2g氢气,故D错误
故选C.
