下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A、C、D是常见的气体单质,F气体极易溶于水,且液态常做制冷剂。
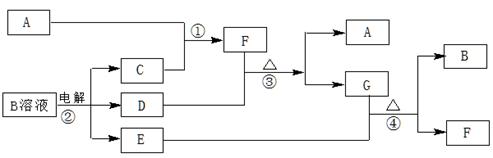
(1)写出化学式A ,D ,F ,G属于 晶体;
(2)鉴定G中阳离子的实验方法和现象__________________________________;
(3)D单质和E溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E溶液反应的离子方程式和③的化学方程式 、 。
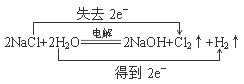
(4)工业上电解B溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目 。
(1)N2、Cl2、NH3、离子晶体; (2)取少量G的溶液加人试管中,用胶头滴管加入少量NaOH浓溶液,加热,用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色 (3)2OH-+Cl2=ClO-+Cl-+H2O
8NH3+3Cl2 ==N2+6NH4Cl
(4)
题目分析:(1)根据F气体极易溶于水,且液态常做制冷剂可知F为NH3,根据反应框图可知A为N2,C为H2,D为Cl2,B为NaCl,E为NaOH,G为NH4Cl,属于离子晶体。
(2)G中阳离子为NH4+,利用NH4+与NaOH反应生成NH3的原理检验,所以检验方法和现象为:)取少量G的溶液加人试管中,用胶头滴管加入少量NaOH浓溶液,加热,用湿润的红色石蕊试纸在试管口检验放出的气体,试纸变蓝色。
(3)Cl2与NaOH反应生成NaCl、NaClO、H2O,离子方程式为:2OH-+Cl2=ClO-+Cl-+H2O;反应③为Cl2与NH3反应生成N2和NH4Cl,化学方程式为:8NH3+3Cl2 ==N2+6NH4Cl。
(4)电解NaCl溶液生成Cl2、H2、NaOH,配平可得化学方程式,根据化合价的变化可标出电子转移的方向和数目。
