A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,A—J的所有物质之间有如下的转化关系(部分反应产物省略):
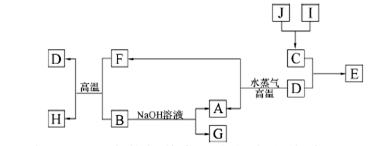
(1)B元素和C元素的简单离子半径大小关系是 (用离子符号表示):
(2)将氮元素与C形成的化合物NC3加入水中产生使红色石蕊试纸变蓝的气体,写出该反应的化学方程式 ;
(3)由E的饱和溶液滴入沸水中形成透明液体,再将此液体装入U型管,并在U型管的两端插入电极,接通直流电,在阳极端可观察到的现象是 ;
(4)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
;
(5)向含有0.1 mol G的溶液中滴加5 mol/L 的盐酸溶液,得到沉淀3.9 g ,则加入盐酸的体积可能为 。
(1)r(Al3+) < r(Cl‑)(或Al3+ < Cl‑)(2)NCl3+ 3H2O = NH3↑+ 3HClO(3)红褐色变浅(答有Cl2生成可给1分)(4)MnO2 + H2O2 + 2H+ = Mn2+ + O2↑ + 2H2O(5)10 mL和50 mL
题目分析:I的浓溶液具有还原性,应为HCl,J是一种黑色固体,可与浓盐酸反应,应为MnO2,二者反应生成C为Cl2,D为常见金属,可与水蒸气反应,应为Fe,则E为FeCl3,A为H2,F为Fe3O4,B能与Fe3O4在高温下反应,且能与NaOH溶液反应,则B为Al,G为NaAlO2,H为Al2O3,则(1)由以上分析可知B元素的简单离子为Al3+,C为Cl-,Al3+有两个电子层,而Cl-有三个电子层,故r(Al3+)< r(Cl‑)(2)红色石蕊试纸变蓝的气体即为氨气,C为Cl2,根据原子数守恒配平反应方程式:NCl3+ 3H2O = NH3↑+ 3HclO(3)E为FeCl3,实验室可用将饱和FeCl3溶液逐滴加入沸水的方法制备氢氧化铁胶体,胶体具有电泳现象,胶体粒子带正电荷,外加电源,可向电源负极移动,则阳极红色加深(4)J为MnO2,根据题意可知反应的离子方程式为MnO2+H2O2+2H+═Mn2++O2↑+2H2O(5)G为NaAlO2,加入少量盐酸时,盐酸与偏铝酸钠反应生成氢氧化铝沉淀,NaAl(OH)4+HCl==NaCl+H2O+Al(OH)3↓,设加入nL盐酸
n×5mol/L  即
即 :5n=1:1,n=0.01L=10mL,加入过量盐酸时盐酸先与偏铝酸钠完全反应,生成氢氧化铝沉淀,盐酸在与氢氧化铝沉淀反应,使沉淀慢慢减少,第一步0.1mol偏铝酸钠完全反应,NaAl(OH)4+HCl==NaCl+H2O+Al(OH)3↓ ,消耗5mol/L的盐酸溶液20ml,即0.1mol,生成氢氧化铝0.1mol,质量为7.8g,又反应后得到沉淀3.9g,即第二步反应氢氧化铝7.8g-3.9g=3.9g,设第二步消耗mL盐酸:3HCl+Al(OH)3=AlCl3+3H2O,
:5n=1:1,n=0.01L=10mL,加入过量盐酸时盐酸先与偏铝酸钠完全反应,生成氢氧化铝沉淀,盐酸在与氢氧化铝沉淀反应,使沉淀慢慢减少,第一步0.1mol偏铝酸钠完全反应,NaAl(OH)4+HCl==NaCl+H2O+Al(OH)3↓ ,消耗5mol/L的盐酸溶液20ml,即0.1mol,生成氢氧化铝0.1mol,质量为7.8g,又反应后得到沉淀3.9g,即第二步反应氢氧化铝7.8g-3.9g=3.9g,设第二步消耗mL盐酸:3HCl+Al(OH)3=AlCl3+3H2O,
m×5  即
即 :5m=1:3,m=30mL
:5m=1:3,m=30mL
一二步总消耗盐酸50mL,故加入盐酸的体积可能为10 mL和50 mL。
