已知Fe(OH)2在潮湿的空气中氧化成Fe(OH)3
(1)该反应的化学方程式为______.
(2)现用下面两种方法制白色的Fe(OH)2沉淀.
方法一:用FeSO4溶液与不含O2的蒸馏水配制的NaOH溶液反应制备.
①除去蒸馏水中溶解的O2常采用的方法是______:
②生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,伸到FeSO4溶液液面______(填“上”或“下”),再挤出NaOH溶液,这样操作的理由是避免Fe(OH)2与空气中的氧气接触而被氧化.
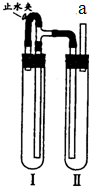
方法二:在如图装置中,用NaOH溶液,铁屑,稀硫酸制备.
(3)制备Fe(OH)2的原理是______、______(用化学方程式表示).
(4)在试管 I里加入的试剂是______.
(5)为了使生成的Fe(OH)2沉淀能较长时间保持白色,在试管 I和试管 II中加入试剂,塞紧塞子后,打开止水夹,当观察到试管 I里出现______现象时,应在a处进行的实验是______(填实验名称).
(1)由Fe(OH)2在潮湿的空气中氧化成Fe(OH)3,需要有氧化剂氧气的参与,该反应的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)由于氧气在水中的溶解随温度的升高而减小,煮沸可以使溶解在水中的氧气逸出;深入到液面下,可以避免被空气中的氧气氧化;
(3)制备Fe(OH)2运用酸碱盐的化学性质和金属的活动顺序可知Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
(4)在试管I里加入的试剂是铁屑和稀H2SO4 (5)铁和稀硫酸反应生成氢气,氢气为可燃性气体,使用之前必须检验它的纯度.
故答案为:(1)4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(2)①煮沸:②下 (填“上”或“下”),
(3)Fe+H2SO4=FeSO4+H2↑、FeSO4+2NaOH=Fe(OH)2↓+Na2SO4
(4)铁屑和稀H2SO4
(5)大量气泡产生、验纯
