问题
选择题
现有部分前四周期元素的性质或原子结构如下表:
| 元素编号 | 元素性质或原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 第三周期主族元素中其第一电离能最大 |
| D | 前四周期呀中其未成对电子数最多 |
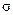 键和__________个
键和__________个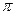 键,元素B的气态氢化物的空间型为________________。
键,元素B的气态氢化物的空间型为________________。(2)C单质的熔点____________A单质的熔点(填“高于”或“低于”),其原因是:_______________
(3)写出元素D基态原子的电子排布式:______________________。
答案
答案:(1)1 2 ,三角锥形






(2)低于 Cl2晶体属于分子晶体,Si晶体属于原子晶体,原子晶体中原子之间以很强的共价键结合,而分子晶体中分子间以较弱的分子间作用力结合,因而原子晶体的熔点比分子晶体的熔点高
(3)1s22s22p63s23p63d54s1
A为第三周期中的半导体材料,得出A为Si;B的L层s电子数比p电子数少1,得出B为N;C在第三周期主族元素中其第一电离能最大,为Cl;D在前四周期呀中其未成对电子数最多,所以为Cr.
