有一包固体粉末,可能是氧化铜和铁粉的混合物,也可能只含有其中的一种物质.通过实验探究,有以下结果:
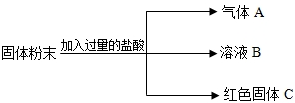
根据以上实验事实判断:(1)这包固体粉末的组成是______;
(2)溶液B中一定含有的溶质是______;
(3)固体C是______,请写出产生该物质的有关反应方程式______.
(1)加入过量稀盐酸后,有气体生成,Fe+2HCl(稀)=FeCl2+H2↑,可知含有铁;有红色固体不溶解,说明有铜生成,CuO+2HCl=CuCl2+H2O,CuCl2+Fe=FeCl2+Cu,所以这包固体粉末的组成是氧化铜粉和铁粉的混合物;
(2)根据铁和盐酸反应生成氯化亚铁和氢气,所以溶液B中一定含有的溶质是氯化亚铁以及剩余的氯化氢;
(3)根据题意可知,红色固体是铜,氢气还原氧化铜可以得到铜,反应方程式为:CuO+H2
Cu+H2O. △ .
故答案为:(1)氧化铜粉和铁粉的混合物;
(2)HCl、FeCl2;
(3)铜、CuO+H2
Cu+H2O. △ .
