问题
问答题
一般情况下,金属越活泼,与酸反应速度越快.为了探究金属Mg、Zn、Fe与酸反应的快慢,某研究性学习小组设计了如下实验(见图).
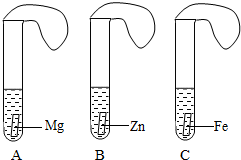
实验步骤
①取A、B、C三支试管,分别加入2mL浓度相同的盐酸溶液;
②分别加入足量的、大小相等的Mg、Zn、Fe,立即把三个相同的气球分别套在各试管口上.
实验预测与分析
(1)写出铁与盐酸反应的化学方程式:______
(2)气球膨胀速度最快的是______(填试管编号).
(3)该实验表明,实验室一般用锌而不选用镁、铁制取氢气的主要原因是:______.
答案
(1)铁与盐酸反应,铁转变为亚铁,即生成氯化亚铁和氢气;
故答:Fe+2HCl=FeCl2+H2↑;
(2)三种金属中,镁的活动性最强,放出氢气速率最大,所以放入镁的A试管气球膨胀速度最快;
故选A;
(3)实验室制取气体时要求反应速度不能太快,反应太剧烈不易收集;也不能反应速度太慢,太慢收集需要太长时间;镁与酸反应太快、铁反应速度太慢,实验室制取氢气时不选用这两种金属;
故答:锌反应速度适中,容易控制(或镁反应速度太快,而反应速度太慢).
