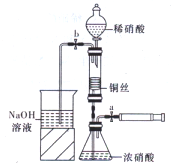
同周期中A、B、C、D、E、F为原子序数依次增大的短周期元素。已知:A、C、F三种原子的最外层共有11个电子,且这三种元素的最高价氧化物对应的水化物之间两两皆能反应,均生成盐和水。请完成下列问题:
(1)根据以上条件一定能判断出的元素有几种,请在下列横线上写出相应的元素符号:
A._____________,B._____________,C._____________,
D._____________,E._____________,F._____________。
(2)已知D单质在F单质中燃烧可能生成两种化合物,请分别写出生成两种化合物的化学方程式: ____________________________________;____________________________________。
(3)若1 mol F的最高价氧化物对应水化物与C的最高价氧化物对应水化物恰好完全反应,则等物质的量的C的最高价氧化物与A的最高价氧化物对应水化物反应消耗_____________mol A的最高价氧化物对应水化物。
(1)Na Mg Al P S Cl (2)2P+3Cl2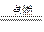 2PCl3 2P+5Cl2
2PCl3 2P+5Cl2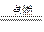 2PCl5 (3)
2PCl5 (3)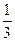
(1)A、C、E三种元素的最高价氧化物对应的水化物之间两者皆反应生成盐和水,那么其中两种最高价氧化物对应水化物应为酸和碱,而另外一种水化物既能与酸反应,又能与碱反应,必为两性氧化物,中学范围内只有Al2O3了。又知A、B、C、D、E、F同周期,且原子序数依次增大,则C应为Al,A为金属,F为非金属,C之前的A、B应依次为Na、Mg。A、C、F最外层电子数共为11,则F最外层电子数为11-1-3=7,所以F应为Cl元素。
(2)D在周期表中位置在Al、Cl之间,可能为Si、P,不可能为S,因为E的序数大于D小于F,那么在Cl2中燃烧生成两种产物的应为P。
3Cl2+2P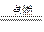 2PCl3
2PCl3
2P+5Cl2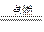 2PCl5
2PCl5
(3)A、F最高价氧化物对应水化物分别为NaOH、HClO4,与C最高价氧化物对应水化物Al(OH)3的反应分别为:
NaOH+Al(OH)3====NaAlO2+2H2O
3HClO4+Al(OH)3====Al(ClO4)3+3H2O
若HCl为1 mol,则Al(OH)3为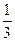 mol,消耗NaOH
mol,消耗NaOH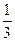 mol。
mol。