A、B、C、D、E、F六种短周期元素的原子序数依次增大。A、D同族,B、C同周期;C是F不同周期的邻族元素;B原子最外层电子数是次外层的两倍;A、B两元素的核电荷数之差等于它们的原子最外层电子数之和;E和F的原子序数之和为30。由上述六种元素中的两种元素组成的甲、乙、丙、丁、戊、己六种化合物如下图所示:
| 化合物 | 甲 | 乙 | 丙 |
| 各元素原子个数比 | N(A)∶N(C)=2∶1 | N(A)∶N(C)=1∶1 | N(B)∶N(A)=1∶1 |
| 化合物 | 丁 | 戊 | 己 |
| 各元素原子个数比 | N(D)∶N(C)=1∶1 | N(E)∶N(F)=1∶3 | N(B)∶N(F)=1∶4 |
(1)化合物己的电子式:__________________________。
(2)向含有1 mol乙的水溶液中加入MnO2,该反应中电子转移的物质的量为____________mol。
(3)化合物丙中所有的原子都在同一直线上,实验室制取丙的化学方程式为_______________。
(4)F的单质与甲反应的离子方程式为___________________________。
(5)将丁与二氧化碳反应生成的盐置于戊的水溶液中,发生反应的离子方程式为___________。
(1)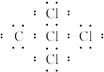 (2)1
(2)1
(3)CaC2+2H2 Ca(OH)2+ CH≡CH↑
Ca(OH)2+ CH≡CH↑
(4)Cl2+H2O====H++Cl-+HClO
(5)3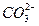 +Al3++3H2O====2Al(OH)3↓+3 CO2↑
+Al3++3H2O====2Al(OH)3↓+3 CO2↑
本题考查元素及其化合物之间的结构、性质的关系。
由B原子最外层电子数比其次外层电子数多2可知,B为C元素,由于A、B、C、D、E、F六种短周期元素的原子序数依次增大,A、B两元素的核电荷数之差等于它们的原子最外层电子数之和可知A为H元素,A、D同族,所以D为Na元素;E和F的原子序数之和为30,且结合表格可知,E为Al元素,F为Cl元素。所以甲为H2O,乙为H2O2,丙为C2H2,丁为Na2O2,戊为AlCl3,己为CCl4。
