| a | |||||||
| b |  |  | c | d | e | f | |
| g | h |
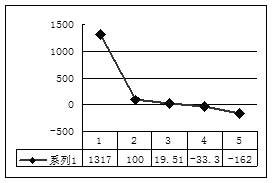
(2)第三周期8种元素按单质熔点(℃)大小顺序的柱形图(上左图,已知柱形“1”代表Ar),则其中序列“2”代表 ,“8”代表 。(均填化学式)
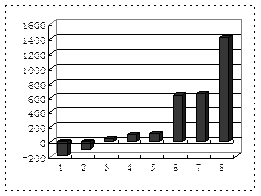
(3)b、c、d、e、f的氢化物的沸点直角坐标图(上右图),序列“5”氢化物的化学式为 ,序列“1”的氢化物的电子式: 。
(4)单质a和单质e可以设计为新型燃料电池,电解质为KOH溶液,则单质a在该燃料电池的______极发生电极反应,电极反应式为____________________________。
(1)2OH—+2Al+2H2O=2AlO2—+3H2↑ (2)Cl2 Si
(3)CH4 Li+[∶H]— (4)负极;H2-2e-==2H+,或:H2+2OH--2e-==2H2O
本题是考查综合应用元素周期表知识的能力题。根据元素周期表知识可判断,a、b、c、d、e、f、g、h八种元素分别为H、Li、C、N、O、F、Na 、Al,则g元素最高价氧化物水化物为NaOH,与h反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+ 3H2↑; 第三周期的八种元素分别为Na、Mg、Al、Si、P、S、Cl、Ar, 根据物质的聚集状态和晶体类型可判断,除Ar外, Cl2常温下为气态熔点最低,Si为原子晶体,熔点最高,则“2”代表Cl2,“8”代表Si;b、c、d、e、f的氢化物分别为LiH、CH4、NH3、H2O、HF,因为LiH为离子化合物,所以沸点最高,序列“1”为LiH;又因NH3、H2O、HF 分子结构中都含氢键,沸点比其他气态氢化物高,所以沸点最低的序列“5”为CH4;氢氧燃料电池,负极为H2、正极为O2,电解质为碱液时的负极反应式为H2-2e-==2H+,或:H2+2OH--2e-==2H2O
